La lactatémie se définit comme la concentration sanguine en acide lactique. Le dosage de la lactatémie est aujourd’hui accessible à tous les praticiens. Il peut être effectué sur des analyseurs au sein de la structure (IDEXX™, SCIL™, Roche™).
Intérêt chez les animaux de compagnie
Il est aussi possible de le demander à certains laboratoires de biologie vétérinaire. L’augmentation de la lactatémie a été décrite dans diverses situations cliniques chez l’animal de compagnie.
La problématique peut se résumer en 3 questions :
- Quand doser la lactatémie ?
- Comment interpréter ce dosage ?
- Quelles en sont les implications cliniques et thérapeutiques ?
Nous nous attacherons dans un premier temps à rappeler la physiologie de la production de l’acide lactique.
Puis nous décrirons les situations lors desquelles une hyperlactatémie a été décrite chez le chien et le chat.
Enfin, nous verrons quelles sont les implications cliniques et thérapeutiques d’une hyperlactatémie.
Rappels physiologiques
A. Que sont les lactates ?
L’acide lactique est un acide faible. La base faible avec laquelle il forme un couple acido-basique est le lactate.
Le pKa de ce couple acido-basique est de 3,86. Dans le sang dont le pH est compris entre 7,35 et 7,45, le lactate est la forme prédominante car le pH sanguin est supérieur au pKa. Le lactate existe sous 2 stéréo-isomères : la forme dextrogyre (D(-)lactate) et la forme lévogyre (L(+)lactate). Les cellules des mammifères excrètent du L(+)lactate.
Le D(-) lactate est produit par des bactéries de la flore intestinale1.
L’auteur fera par la suite référence au(x) lactate(s) pour parler indifféremment de l’acide lactique et du lactate sous leur forme lévogyre sauf mention particulière.
B. Comment les lactates sont-ils produits ?
La production de lactates est la résultante du métabolisme anaérobie du glucose (figure 1).
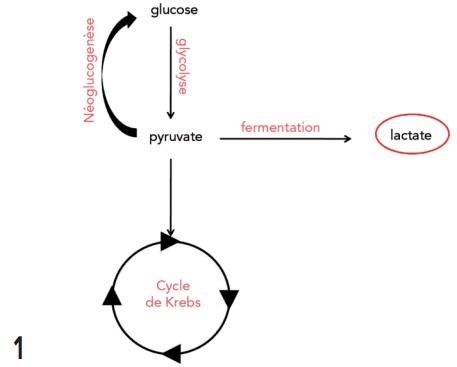
Elle est physiologique chez les mammifères. Tous les tissus ont la capacité de les produire.
Dans des conditions normales, les muscles squelettiques, le cerveau, les érythrocytes et les reins sont à l’origine de la majorité de la production.
Le glucose suit la voie de la glycoyse qui aboutit à la production de pyruvate. Le pyruvate peut alors suivre 3 voies :
- Entrer dans le cycle de Krebs.
- Suivre la voie de la fermentation.
- Suivre la voie de la néoglucogenèse.
Les lactates sont un produit de la fermentation. Il s’agit d’une voie métabolique anaérobie. Ils sont éliminés par le foie (70 %) et les reins (30 %)1
C. Dans quelle proportion leur production est-elle normale ?
Un organisme sain produit des lactates de manière physiologique. La limite supérieure usuelle de la lactatémie est de 2,5 mmol / l chez le chien et 2 mmol / l chez le chat1
Augmentation de la lactatémie
Une hyperlactatémie est-elle pathologique ?
Une mesure de la lactatémie ne peut être interprétée seule. Elle doit systématiquement être corrélée à l’examen clinique du patient ainsi qu’au contexte dans lequel elle est effectuée.
Plusieurs études ont montré qu’une hyperlactatémie pouvait être observée sur des animaux sains.
Les principaux facteurs de variation sont physiologiques, analytiques et iatrogènes.
Une équipe a comparé les lactatémies de 68 chiots âgés de 4 à 80 jours avec celles de 30 chiens adultes. Tous les animaux étaient sains.
Les lactatémies des chiots âgés de 4 à 28 jours étaient significativement plus élevées que celle des adultes2.
Ilkiw et al. ont dosé la lactatémie chez des Greyhounds bien portants avant et après qu’ils aient effectué une course. La lactatémie est passée de 0,57 mmol / l à plus de 28 mmol / l suite à l’exercice. Elle est ensuite revenue à une valeur de 0,53 mmol / l en 3 heures.
En tenant compte du contexte , cette hyperlactatémie, bien que très importante, n’est pas le reflet d’une maladie dont le chien souffre mais de l’exercice intense auquel il a été soumis.
Les variations analytiques peuvent dépendre de la méthode de prélèvement sanguin et du temps écoulé entre le prélèvement sanguin et l’analyse.
L’analyse doit être effectuée rapidement. Comme décrit précédemment, les érythrocytes peuvent être à l’origine de la production de lactates.
Dans un prélèvement sanguin laissé à 25 °C, la lactatémie peut augmenter de 20 % toutes les heures1.
Si le sang est prélevé dans un cathéter, une attention particulière doit être portée sur sa bonne vidange.
Deux études ont montré que les prélèvements sanguins effectués sur des cathéters ayant servi à administrer un soluté glucosé ou du Ringer Lactate peuvent être faussement élevés si la vidange du cathéter n’est pas correctement effectuée4, 5.
L’attention du lecteur est portée sur le fait que l’utilisation de Ringer Lactate comme soluté de perfusion n’est pas incriminée. US et al. ont traité 12 chiens souffrant d’une hémorragie par l’administration d’un soluté hypertonique (NaCl 7,5 %, 4ml / kg, n = 6) ou d’un soluté cristalloïde (Ringer Lactate, 20 ml / kg, n = 6). Malgré le fait que le Ringer Lactate contienne 28 mmol / l de lactate, la lactatémie des 2 groupes ne présentait pas de différence significative.
Enfin, certains auteurs ont décrit une hyperlactatémie iatrogène.
Une étude a porté sur 12 chiens sains. L’administration de prednisone aux doses de 1 mg / kg / jour et 4 mg / kg / jour a provoqué une augmentation significative e de la lactatémie aux 4e et 14e jours de traitement.
Une autre équipe a montré que, chez des chiens sains, l’administration de charbon activé contenant du propylène7 glycol et du glycérol administré à la dose de 4 g / kg augmentait la lactatémie de manière significative pendant 8 heures8.
Les différents types d’hyperlactatémie
L’hyperlactatémie peut être associée à de nombreuses situations pathologiques. Elle a été décrite chez les chiens souffrant
- d’une affection traumatique9
- de l’ingestion de corps étranger10
- d’une insuffisance cardiaque congestive11
- d’affection intracrânienne12
- d’un syndrome de dilatation torsion de l’estomac13—15
- d’une anémie hémolytique autoimmune16, 17
- d’un pyomètre18
- d’une babésiose19, 20
- d’une infection grave des tissus mous21, 22
- d’un syndrome de réponse inflammatoire systémique ou de maladie systémique nécessitant l’admission en soins intensifs23, 24.
Chez le chat, l’hyperlactatémie a été plus rarement décrite. Les descriptions concernent les patients souffrant
- d’insuffisance cardiaque congestive11
- d’infection des tissus mous25 .
À défaut d’étude spécifique, les causes d’hyperlactatémie du chien sont considérées comme transposables au chat.
L’hyperlactatémie peut être la conséquence de deux mécanismes physiopathologiques : type A et type B1, 26.
Il est possible que ces mécanismes soient contemporains sur un même patient.
- L’hyperlactatémie de type A regroupe les affections au cours desquelles le patient souffre d’une hypoxie.
La quantité d’oxygène délivrée aux tissus est inférieure à la demande tissulaire.
Dans ces circonstances, le métabolisme du glucose est orienté vers la voie anaérobie: la fermentation.
Il en découle une augmentation de la production des lactates.
Au sein du type A, 2 sous-groupes peuvent être distingués.- L’un est représenté par les affections à l’origine d’une diminution de la quantité d’oxygène délivrée aux tissus.
- L’autre regroupe les affections à l’origine d’une augmentation de la demande tissulaire en oxygène.
- L’hyperlactatémie de type B regroupe les affections au cours desquelles une hyperlactatémie est présente en l’absence d’épisode hypoxique.
Il peut être distingué les maladies à l’origine d’un défaut d’excrétion, d’une utilisation inadéquate de l’oxygène, les intoxications et les anomalies métaboliques congénitales.
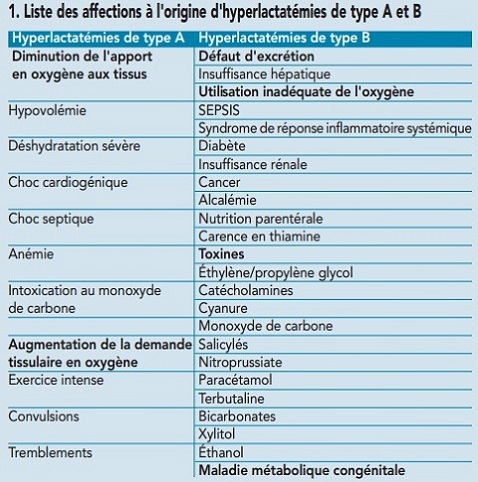
Le tableau 1 présente la liste des affections à l’origine d’hyperlactatémie de type A et de type B.

Cas particulier de l’hyperlactatémie aux D(-)lactates
Les analyseurs disponibles à ce jour dosent tous les énantiomères des lactates. Il est impossible de différencier aisément les D(-)lactates, issus de la production bactérienne, des L(+)lactates, issus de la production des cellules des mammifères.
Le recours à un examen chromatographique et/ou par spectrométrie de masse est nécessaire. Les hyperlactatémies dues aux D(-)lactates sont rares. Un rapport a décrit cette affection chez un chat de 2 ans souffrant d’une insuffisance pancréatique exocrine27.
L’hypothèse développée par les auteurs est celle d’une augmentation de la population bactérienne intestinale secondaire à l’affection pancréatique. Cette surpopulation bactérienne aurait été à l’origine d’une production accrue de D(-)lactates dans la lumière intestinale.
Les D(-)lactates auraient traversé la barrière intestinale provoquant une augmentation de la lactatémie.
Utilisation clinique de la mesure de la lactatémie
La lactatémie donne une indication de la gravité de l’affection
Dans la pratique quotidienne la mesure de la lactatémie est le moyen le plus simple et le plus accessible pour le praticien d’évaluer l’oxygénation des tissus du patient. L’hyperlactatémie de type A est la plus fréquemment rencontrée1.
Lorsqu’une hyperlactatémie est mesurée, cela peut signifier qu’un état de choc est présent, même s’il n’est que débutant et compensé. Les apports en oxygène ne sont pas suffisants pour couvrir les besoins du patient. Le métabolisme anaérobie prend alors le relais.
L’identification d’une hyperlactatémie est un argument pertinent qui permet d’engager des mesures de réanimation précoces (oxygénothérapie, fluidothérapie, analgésie).
Depuis quelques années les recommandations lors de réanimations sont d’appliquer une « end points resuscitation » ou « early goal-directed therapy»28.
Cette stratégie consiste à considérer un certain nombre de variables physiologiques du patient (fréquence cardiaque, fréquence respiratoire, température, douleur, pression artérielle…).
L’objectif du réanimateur est d’utiliser tous les moyens dont il dispose afin de les ramener chacune aux valeurs considérées comme normales pour le patient. La lactatémie est l’une de ces variables et son retour à une concentration sanguine < 2,5 mmol /l est considéré comme une priorité.
La mesure de la lactatémie à l’admission du patient : un facteur pronostique ?
En médecine humaine, de nombreuses publications font état d’une corrélation entre une hyperlactatémie mesurée à l’admission du patient et la mortalité. Par exemple, Kamolz et al. ont étudié 166 patients souffrant de brûlures importantes en 2005.
Le taux de mortalité du groupe présentant une lactatémie < 2 mmol / l à l’admission était de 10 %.
Le taux de mortalité du groupe présentant une hyperlactatémie élevée à l’admission était de 59 %.
L’aspect pronostique de la lactatémie à l’admission du patient a aussi été étudié chez l’animal de compagnie. Les études se sont heurtées à deux difficultés majeures D’une part le recrutement de larges cohortes de patients par des structures vétérinaires est difficile
Prenons pour exemple le syndrome de dilatation torsion d’estomac chez le chien. Cette affection est rencontrée régulièrement par tous les vétérinaires. Kamolz et al. dans leur étude de 2005, ont recruté 166 patients humains grands brulés.
Chacun peut réaliser la difficulté de recruter le même nombre de chiens atteints d’un syndrome de dilatation torsion d’estomac, même par une structure de dimension universitaire.
Un risque statistique d’un défaut de recrutement est l’erreur de type II. Du fait d’un effectif trop faible, l’analyse statistique de deux variables, ici la lactatémie et la mortalité, ne permet pas de les corréler alors qu’en réalité elles le sont.
D’autre part, les traitements administrés aux patients sont hétérogènes en médecine vétérinaire.
Dans l’exemple du syndrome de dilatation torsion d’estomac chez le chien certains patients recevront un soluté cristalloïde isotonique, d’autres un mélange de soluté cristalloïde isotonique et hypertonique, d’autres encore recevront des colloïdes de synthèse.
Cette absence d’harmonisation est à l’honneur du praticien car elle montre qu’il adapte son traitement à chaque patient. D’un point de vue statistique, est difficile de comparer deux individus qui n’ont pas reçu le même traitement. Malgré ces deux difficultés analytiques plusieurs études ont permis d’établir certaines corrélations.
Différents auteurs ont démontré que chez le chien souffrant d’un syndrome de dilatation torsion d’estomac une hyperlactatémie mesurée à l’admission du patient était corrélée à la mortalité13—15 .
La valeur pronostique d’une hyperlactatémie mesurée à l’admission du patient a aussi été démontrée chez les chiens souffrant d’anémie hémolytique auto immune17 , chez les chiens atteints de babésiose20 , chez les chiens souffrant d’une inflammation sévère des tissus mous21 , chez les chiens admis dans un service de soins intensifs23 et chez les chats souffrants de péritonite traitée chirurgicalement25.
À l’inverse, des études ayant porté sur des chiens ayant subi un traumatisme9 , des chiens ayant ingéré un corps étranger10, des chiens et des chats souffrant d’insuffisance cardiaque congestive11 et des chiennes souffrant d’un pyomètre18 , n’ont pas permis d’établir une relation significative entre la lactatémie et la survie des patients.
Évolutions de la prise en compte et de l’interprétation de la lactatémie
Face à l’hétérogénéité de ces résultats plusieurs auteurs ont proposé une utilisation différente de la mesure de la lactatémie.
En s’inspirant de la pratique des réanimateurs humains, une équipe a considéré que le métabolisme des mammifères était trop complexe pour n’être appréhendé que par la mesure d’un métabolite.
Ils ont posé pour hypothèse que la mortalité d’un animal au cours de son hospitalisation serait mieux corrélée à plusieurs variables mesurées à l’admission. C’est la notion de score. Ainsi, Hayes et al. ont proposé le score APPLE pour le chien et le chat.
Le principe consiste à mesurer 10 variables chez le chien et 8 chez le chat (figures 2 et 3).
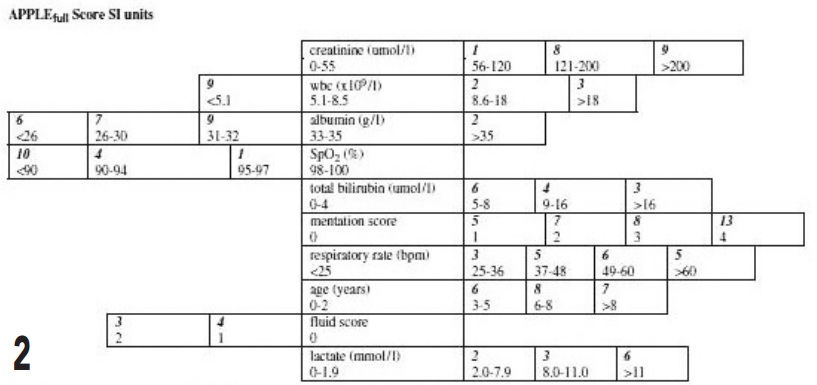
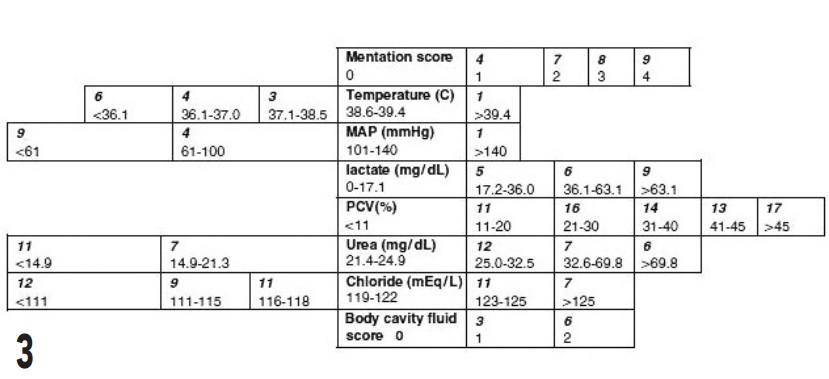
La lactatémie fait partie des variables mesurées dans les deux espèces. A chaque valeur de ces variables correspond un chiffre. La somme de ces chiffres constitue le score. Ces scores, testés sur 600 chats et 810 chiens admis en soins intensifs, ont été corrélés à la mortalité des patients.
Une seconde attitude consiste non plus à ne doser les lactates que lors de l’admission mais à les doser régulièrement lors de l’hospitalisation du patient.
L’intervalle entre les mesures n’a pas été clairement défini. L’auteur recommande un dosage toutes les 6 heures.
L’hypothèse émise est qu’une diminution de la lactatémie au cours de l’hospitalisation serait significativement corrélée à la survie du patient. Cette hypothèse découle elle aussi des observations faites par les réanimateurs humains32 .
En 2004, Nel et al. ont dosé la lactatémie de 90 chiens atteints de babésiose à l’admission ainsi que 8 et 16 heures après l’initiation du traitement.
Considérant les patients qui présentaient une hyperlactatémie à l’admission, ceux dont la lactatémie n’avait pas diminué de 50 % lors des dosages à 8 et 16 heures post admission ont présenté une probabilité significativement plus importante de mourir au cours de leur hospitalisation.
Des résultats similaires ont été retrouvés par d’autres équipes qui ont étudié des chiens atteints d’anémie hémolytique auto-immune17 , des chiens atteints d’un syndrome de dilatation torsion d’estomac14, 15 et une population de chiens atteints de diverses affections nécessitant une admission dans un service de soins intensifs24.
L’évaluation de la lactatémie est donc accessible à tous les praticiens. Si plusieurs types d’hyperlactatémie ont été décrits, elle peut être la conséquence d’un déficit en oxygène à l’échelle cellulaire. Elle doit amener à considérer la mise en place d’une réanimation adaptée (oxygénothérapie, fluidothérapie, analgésie).
Le dosage de l’acide lactique, qu’il soit effectué à l’admission du patient, en série toutes les 6 heures ou par son intégration à un score physiologique, apporte souvent des informations sur le pronostic de l’affection considérée.
Bibliographie
- Pang DS, Boysen S. Lactate in veterinary critical care: pathophysiology and management. J Am Anim Hosp Assoc. 2007 Sep-Oct;43(5):270-9.
- McMichael MA, Lees GE, Hennessey J, Sanders M, Boggess M, plasma lactate concentrations in 68 puppies aged 4 to 80 days. J Vet Emerg Crit Care. 2005 15(1):17-21.
- Ilkiw JE, Davis PE, Church DB. Hematologic, biochemical, blood-gas, and acid-base values in greyhounds before and after exercise. Am J Vet Res. 1989 Apr;50(4):583-6.
- Jackson EV Jr, Wiese J, Sigal B, Miller J, Bernstein W, Kassel D, Aduen J, Bhatiani A, Kerzner R, Davidson L, Miller C, Chernow B.Ef ects of crystalloid solutions on circulating lactate concentrations: Part 1. Implications for the proper handling of blood specimens obtained from critically ill patients. Crit Care Med. 1997 Nov;25(11):1840-6.
- Didwania A, Miller J, Kassel D, Jackson EV Jr, Chernow B. Ef ect of intravenous lactated Ringer’s solution infusion on the circulating lactate concentration: Part 3. Results of a prospective, randomized, double-blind, placebo-controlled trial. Crit Care Med. 1997 Nov;25(11):1851-4.
- MH Us, S Özkan, L Oral, T Ogus, HV Acar, O Çakir, Ö Keskin, C Top , M Gökben. Comparison of the ef ects of hypetonic saline and crystalloid infusions on haemodynamic parameters during haemorrhagic shock in dogs. The Journal of International Medical Research. 2001;29(6):508–515.
- Boysen SR, Bozzetti M, Rose L, Dunn M, Pang DS. Ef ects of prednisone on blood lactate concentrations in healthy dogs. J Vet Intern Med. 2009 Sep-Oct;23(5):1123-5.
- Burkitt JM, Haskins SC, Aldrich J, Jandrey KE, Rezende ML, Boyle JE. Ef ects of oral administration of a commercial activated charcoal suspension on serum osmolality and lactate concentration in the dog. J Vet Intern Med. 2005 Sep-Oct;19(5):683-6.
- Simpson SA, Syring R, Otto CM, Severe blunt trauma in dogs: 235 cases (1997-2003) J Vet Emerg Crit Care. 2009 19(6):588–60.
- Boag AK, Coe RJ, Martinez TA, Hughes D. Acid-base and electrolyte abnormalities in dogs with gastrointestinal foreign bodies. J Vet Intern Med. 2005 Nov-Dec;19(6):816-21.
- Goutal CM, Keir I, Kenney S, Rush JE, Freeman LM. Evaluation of acute congestive heart failure in dogs and cats: 145 cases (2007-2008). J Vet Emerg Crit Care. 2010. 20(3):330-337
- Sullivan LA, Campbell VL, Klopp LS, Rao S. Blood lactate concentrations in anesthetized dogs with intracranial disease. J Vet Intern Med. 2009 May-Jun;23(3):488-92.
- de Papp E, Drobatz KJ, Hughes D. Plasma lactate concentration as a predictor of gastric necrosis and survival among dogs with gastric dilatation-volvulus: 102 cases (1995-1998). J Am Vet Med Assoc. 1999 Jul 1;215(1):49-52.
- Green TI, Tonozzi CC, Kirby R, Rudlof E. Evaluation of initial plasma lactate values as a predictor of gastric necrosis and initial and subsequent plasma lactate values as a predictor of survival in dogs with gastric dilatation-volvulus: 84 dogs (2003-2007). J Vet Emerg Crit Care. 2011 Feb;21(1):36-44.
- Zacher LA, Berg J, Shaw SP, Kudej RK. Association between outcome and changes in plasma lactate concentration during presurgical treatment in dogs with gastric dilatation-volvulus: 64 cases (2002-2008). J Am Vet Med Assoc.. 2010;236(8):892–897.
- Weinkle TK, Center SA, Randolph JF, et al. Evaluation of prognostic factors, survival rates, and treatment protocols for immunemediated hemolytic anemia in dogs: 151 cases (1993–2002). J Am Vet Med Assoc 2005; 226(11):1869–1880.
- Holahan ML, Brown AJ, Drobatz KJ. The association of blood lactate concentration with outcome in dogs with idiopathic immune-mediated hemolytic anemia: 173 cases (2003-2006). J Vet Emerg Crit Care. 2010 Aug;20(4):413-20.
- Hagman R, Reezigt BJ, Bergström Ledin H, Karlstam E. Blood lactate levels in 31 female dogs with pyometra. Acta Vet Scand. 2009 Jan 9;51:2.
- Nel M,. Lobetti RG, Keller N, Thompson PN Prognostic Value of Blood Lactate, Blood Glucose, and Hematocrit in Canine Babesiosis. J Vet Intern Med 2004;18:471–476.
- Jacobson LS, Lobetti RG. Glucose, lactate, and pyruvate concentrations in dogs with babesiosis. Am J Vet Res. 2005 Feb;66(2):244-50.
- Buriko Y, Van Winkle TJ, Drobatz KJ, Rankin SC, Syring RS. Severe soft tissue infections in dogs: 47 cases (1996–2006). J Vet Emerg Crit Care. 2008 Dec;18(6):608-18.
- Gower SB, Weisse CW, Brown DC. Major abdominal evisceration injuries in dogs and cats: 12 cases (1998–2008). J Am Vet Med Assoc.. 2009;234(12):1566–1572.
- Lagutchik MS, Ogilvie GK, Hackett TB, Wing?eld WE. Increased Lactate Concentrations in III and Injured Dogs. J Vet Emerg Crit Care. 1998 May;8(2):117-27.
- Stevenson CK, Kidney BA, Duke T, Snead EC, Mainar-Jaime RC, Jackson ML. Serial blood lactate concentrations in systemically ill dogs. Vet Clin Pathol. 2007 Sep;36(3):234-9.
- Parsons KJ, Owen LJ, Lee K, Tivers MS, Gregory SP. A retrospective study of surgically treated cases of septic peritonitis in the cat (2000-2007). J Small Anim Pract. 2009 Oct;50(10):518-24.
- Fall PJ, Szerlip HM. Lactic acidosis: from sour milk to septic shock. J Intensive Care Med. 2005 Sep-Oct;20(5):255-71.
- Packer RA, Cohn LA, Wohlstadter DR, Shelton GD, Naylor JM, Zello GA, Ewaschuk JB, Williams DA, Ruaux CG, O’Brien DP. D-lactic acidosis secondary to exocrine pancreatic insuf?ciency in a cat. J Vet Intern Med. 2005 Jan-Feb;19(1):106-10.
- Prittie J. Optimal endpoints of resuscitation and early goal-directed therapy. J Vet Emerg Crit Care (San Antonio). 2006 Dec;16(4):329-39.
- Kamolz LP, Andel H, Schramm W, et al. Lactate: early predictor of morbidity and mortality in patients with severe burns. Burns. 2005;31(8):986–990.
- Hayes G, Mathews K, Doig G, Kruth S, Boston S, Nykamp , Poljak Z, Dewey C. The Acute Patient Physiologic and Laboratory Evaluation (APPLE) Score: A Severity of Illness Strati?cation System for Hospitalized Dogs. J Vet Intern Med 2010;24:1034–47.
- Hayes G, Mathews K, Doig G, Kruth S, Boston S, Nykamp , Poljak Z, Dewey C. The Feline Acute Patient Physiologic and Laboratory Evaluation (Feline APPLE) Score: A Severity of Illness Strati?cation System for Hospitalized Cats. J Vet Intern Med 2011;25:26–38
- Donnino MW, Miller J, Goyal N, et al. Ef ective lactate clearance is associated with improved outcome in post-cardiac arrest patients. Resuscitation. 2007;75(2):229–234.
- Nel M, Lobetti RG, Keller N, Thompson PN.Prognostic Value of Blood Lactate, Blood Glucose, and Hematocrit in Canine Babesiosis. J Vet Intern Med 2004;18:471–76
Auteur
 Dr. Christophe Bille
Dr. Christophe Bille
Centre Hospitalier Vétérinaire des Cordeliers,
29 avenue du Maréchal Joffre,
77100 Meaux.
E-mail : cbille@chvcordeliers.com
www.chvcordeliers.com