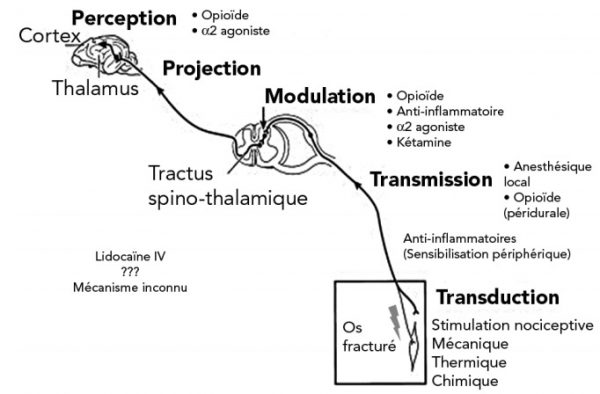
La douleur est considérée comme le quatrième paramètre vital après le pouls, la respiration et la température. Elle est mieux contrôlée par l’administration conjointe de molécules de différentes classes (opioïdes, anti-inflammatoires non stéroïdiens, anesthésiques locaux, α2 agonistes, adjuvants).
Intérêt d’une prise en charge multimodale
Cette association, plus efficace, permet de diminuer les doses utilisées et donc les effets secondaires indésirables.
L’Association Internationale pour l’Etude de la Douleur (IASP) définit celle-ci comme une expérience sensorielle et émotionnelle désagréable liée à des lésions tissulaires réelles ou potentielles ou décrites en termes de telles lésions1.
En 1999, au Royaume-Uni, une enquête auprès de 958 vétérinaires a révélé que seuls 53 % des animaux subissant une ovario-hystérectomie et 71 % des animaux subissant une chirurgie abdominale ont reçu un analgésique (opioïde ou anti-inflammatoire). Le chirurgien, dans 6,5 % des cas estimait que « l’intervention chirurgicale considérée ne (provoquait) pas suffisamment de douleur pour qu’elle justifie un traitement. »2.
En une décennie, les mentalités ont commencé à évoluer et l’ensemble de la communauté scientifique semble s’accorder pour dire que la douleur, si elle n’est pas traitée, augmente les risques de morbi-mortalité pour une affection donnée1, 3.
L’American Animal Hospital Association recommande aux vétérinaires de considérer la douleur comme le quatrième signe vital après le pouls, la respiration et la température1.
Cet article a pour objectif de présenter le traitement multimodal de la douleur par des principes actifs injectables chez les animaux hospitalisés.
Apres avoir exposé le support anatomique du message nociceptif, nous définirons le concept d’analgésie multimodale. Nous envisagerons alors la place des différentes molécules injectables accessibles aux vétérinaires dans le traitement de la douleur des animaux hospitalisés.
Physiologie de la douleur
De la transduction à la perception
La nociception est un processus physiologique composé de la transduction, la transmission, la modulation, la projection et la perception du message douloureux (figure 1).
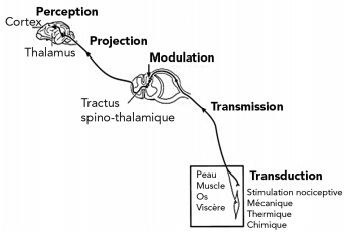
La transduction correspond à la transformation d’une stimulation chimique, mécanique ou thermique en message nerveux douloureux par les nocicepteurs. Ce sont des terminaisons nerveuses libres qui répondent à des stimulations mécaniques, chimiques ou thermiques. Ils sont présents dans la peau, les muscles, les articulations, les os et les viscères1, 4.
La sensibilité périphérique est transmise par 3 types de fibres : Aß, Aδ et C. Dans des conditions normales, les fibres Aß conduisent les informations sensorielles non douloureuses comme les frottements, les vibrations, la pression ou la proprioception. Les fibres Aδ et C sont le support des messages douloureux. Elles portent les nocicepteurs. Le message nociceptif est conduit par les fibres Aδ et C jusqu’à la corne dorsale de la moelle épinière, dans la substance grise. C’est la transmission1, 4.
Au sein de la moelle épinière, un relais synaptique permet une modulation locale du message nociceptif par l’intervention de 3 types de neurones post synaptiques. Il s’agit des inter-neurones modulateurs (responsables de la modulation locale du message), des neurones moteurs (responsables de l’arc réflexe) et des neurones des voies ascendantes (qui participent à la projection). Le neuromédiateur mis en jeu est le glutamate. Il interagit principalement avec 2 récepteurs : AMPA(5-α-amino-3-hydroxy-5-methyl-4-isoxazolepropionicacid) et NMDA(N-methylD-aspartate)1, 4.
Les voies ascendantes dirigent alors le message vers les centres intégrateurs (thalamus, hypothalamus, formation réticulée) par les voies spinothalamique, spinoréticulée ou trigéminale. C’est la projection1, 4 .
L’intégration du message par les structures corticales constitue la perception1, 4.
Les sensibilisations sont à l’origine de l’amplification du message douloureux
Des mécanismes régulateurs sont en permanence mis en place par l’organisme. Le message nociceptif peut être amplifié par les phénomènes de sensibilisations périphérique et centrale. Ils sont évoqués séparément à des fins pédagogiques. Dans des conditions cliniques, ils sont intriqués et indissociables1, 4, 5.
Les lésions tissulaires et l’inflammation sont à l’origine de la libération de certaines substances (médiateurs de l’inflammation, hydronium, potassium, adénosine triphosphate, substance P…) dans l’environnement des nocicepteurs. On parle de sensibilisation périphérique. Elle est à l’origine d’une réponse exagérée à un stimulus nociceptif dans l’environnement direct de la lésion : c’est l’hyperalgésie périphérique. Elle peut aussi provoquer une augmentation de la réactivité des nocicepteurs à une stimulation non douloureuse dans des conditions normales: on parle d’allodynie1, 4, 5.
Le relais synaptique dans la moelle épinière peut aussi être le siège d’une sensibilisation : c’est la sensibilisation centrale. Même si de nombreux points font encore l’objet de débats d’experts, certains mécanismes sont acceptés. Des stimulations nociceptives répétées et intenses sont à l’origine d’une sommation temporelle ou wind up. Ce phénomène active les récepteurs NMDA et abaisse le seuil d’excitabilité des neurones post synaptiques. Il en résulte une sensibilisation de régions distantes de plusieurs centimètres de la zone lésée : c’est l’hyperalgésie centrale. La sensibilisation centrale est aussi à l’origine d’un second mécanisme d’allodynie par le recrutement des fibres Aß. Celles-ci sont, dans des conditions normales, le support de messages sensoriels non douloureux. Dans un contexte de sensibilisation centrale, ce message peut être interprété comme un message douloureux1, 4, 5.
Le concept de l’analgésie multimodale
Au cours des dernières décennies, les avancées dans la compréhension de la physiologie de la douleur ont permis d’élaborer des stratégies d’analgésies plus efficaces.
L’analgésie multimodale a pour objectif d’agir sur les différentes étapes de la propagation du message nociceptif. Elle repose sur l’utilisation conjointe de principes actifs de classes différentes et/ou différentes méthodes d’administration. Cette stratégie permet d’utiliser les propriétés additives ou synergiques des molécules. Elle va aussi avoir pour conséquence de diminuer les doses utilisées pour obtenir une analgésie efficace et donc diminuer la fréquence d’apparition des effets indésirables4, 5.
Transduction
Aucune molécule active sur la transduction n’est aujourd’hui accessible aux vétérinaires4, 5.
Transmission
Les molécules les plus utilisées pour bloquer la conduction du message nociceptif dans les fibres périphériques sont les anesthésiques locaux (lidocaïne 2 % et bupivacaïne 0,5 %). Elles inhibent le fonctionnement des canaux sodiques et empêchent ainsi la conduction du message nerveux. Elles peuvent être injectées directement le long des trajets des nerfs concernés (bloc du plexus brachial, bloc costal, bloc des nerfs crâniens, ring bloc, bloc sous cutané) ou concerner leurs racines (injection péridurale)4, 5.
Les opioïdes, notamment la morphine, peuvent être administrés par voie péridurale4, 5.
La médétomidine, un α2 agoniste, pourrait potentialiser l’effet analgésique des anesthésiques locaux lorsqu’un mélange est injecté par voie péridurale6.
Modulation
Les opioïdes, les α2 agonistes et les anti-inflammatoires non stéroïdiens (AINS) sont les principales molécules qui, lorsque injectées par voie intraveineuse agissent sur le relais synaptique du message nociceptif situé dans la corne dorsale de la moelle épinière. Les morphiniques et le α2 agonistes agissent sur 2 récepteurs différents. Leur répartition semble être la même : pré et post synaptique. Utilisés conjointement, ils ont un effet synergique4, 5, 6.
Le mode d’action central des AINS n’est pas connu4, 5, 7. Néanmoins, plusieurs études ont montré que sur des animaux sains, ne présentant aucune inflammation, l’utilisation des AINS augmente le seuil de tolérance à une stimulation nociceptive7, 8, 9. Cette action est antagonisée chez le rat et le mouton lorsque de la naloxone (antagoniste opioïde) et de l’atipamézole (antagoniste α2 agoniste) sont administrés conjointement8, 9.
Projection et perception
Les opioïdes et les α2 agonistes agissent sur les structures thalamo-corticales et diminuent la perception de la douleur4, 5, 6.
Les benzodiazépines, les phénothiazines (acépromazine) et la plupart des anesthésiques généraux n’ont pas d’action analgésique connue chez les animaux. La perte de conscience du patient ne doit pas être considérée comme une méthode de prise en charge de la douleur4.
La sensibilisation périphérique
Les AINS administrés par voie intraveineuse vont inhiber la production de certaines molécules de l’inflammation responsables de la sensibilisation périphérique. Leur action ne concerne que les molécules issues de l’activité des cyclo-oxygénases.
Ainsi les molécules comme la bradykinine, les ions hydronium, potassium, l’adénosine triphosphate ou la substance P continuent d’avoir un effet sensibilisateur4, 5.
La morphine a montré son efficacité lorsqu’elle est injectée dans une articulation inflammée10 .
La sensibilisation centrale
Depuis une vingtaine d’année la kétamine utilisée à des doses infra-anesthésiques a montré son efficacité lors de son utilisation chez les humains et les animaux. Après un bolus de 0,5 mg/kg, elle est administrée par perfusion continue à une concentration comprise entre 0,1 et 0,6 mg/kg/heure6 . Le temps de perfusion optimal reste à déterminer. La durée maximale d’évaluation chez le chien a été de 18 heures11.
La lidocaïne par voie intra veineuse : un analgésique ?
Chez le chien subissant une chirurgie oculaire, la lidocaïne, administrée par voie intraveineuse (bolus de 1 mg/kg) puis en perfusion continue (0,025 mg/kg/min) pendant la durée de l’intervention a montré une efficacité comparable à la morphine (0,15 mg/kg par voie intraveineuse) dans la gestion de la douleur post opératoire12. Le mécanisme d’action est inconnu6. Cet effet n’a pas été décrit chez le chat.
Le tableau 1 expose les principes actifs ainsi que les doses et voies d’administration chez le chien et le chat. La figure 3 montre les sites d’action des différents principes actifs. La compréhension des mécanismes physiologiques de la douleur, même si elle reste incomplète, a permis de mettre en évidence certaines étapes sur lesquelles il est possible d’agir conjointement.
Ainsi, il n’est plus recommandé de substituer un antalgique puissant à un autre principe actif, un anti-inflammatoire par exemple, mais d’associer les 2 classes dans un même protocole. C’est le concept de l’analgésie multimodale. Il repose sur l’administration de principes actifs de classes différentes agissant sur les étapes de la propagation du message nociceptif. Ces combinaisons permettent de mettre à profit la complémentarité et éventuellement la synergie de ces molécules.
Elles permettent aussi de diminuer les doses utilisées et donc de diminuer la probabilité d’apparition des effets secondaires.
Il peut aussi être intéressant d’utiliser différentes voies d’administration (péridurale, intraveineuse, infiltration locale) afin d’agir directement au contact des fibres nerveuses.
Un exemple pratique : contrôle de la douleur sur une fracture du fémur traitée chirurgicalement
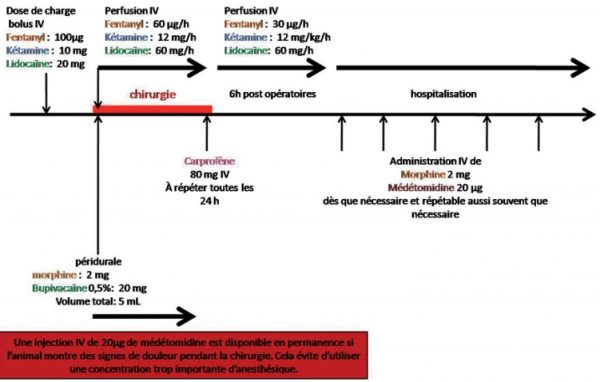
Prenons l’exemple d’un chien de 20 kg présentant une fracture fémorale traitée chirurgicalement (figure 2). L’animal reçoit une péridurale (mélange de morphine et bupivacaïne) avant le début de la chirurgie (photo 1).
Un mélange de fentanyl, lidocaïne et kétamine est administré à l’aide de pousses seringues pendant la chirurgie (photo 2). Pendant la période opératoire, de la médétomidine est disponible pour être administrée si le besoin s’en fait sentir. En fin d’intervention une injection d’anti-inflammatoire est effectuée. Le mélange de fentanyl, lidocaïne et kétamine est administré pendant encore 6 heures. La dose de fentanyl est diminuée. Après ce délai, la douleur est évaluée toutes les heures et une injection de morphine et de médétomidine est effectuée dès que la douleur est jugée mal contrôlée. Sur les 36 heures d’hospitalisation le chien a reçu 7 principes actifs différents (fentanyl, morphine, kétamine, lidocaïne, bupivacaïne, médétomidine, carprofène). Deux voies d’administrations ont été utilisées (intraveineuse et péridurale). Deux régimes d’administration intraveineuse différents (bolus et perfusion continue) ont été utilisés afin de maîtriser au mieux la cinétique d’action des principes actifs. Cette approche aura permis d’agir sur la transmission, la modulation, la perception, la sensibilisation centrale et la sensibilisation périphérique (figure 3).

Bibliographie
- AAHA/AAFP Pain Management Guidelines Task Force Members, Hellyer P, Rodan I, Brunt J, Downing R, Hagedorn JE, Robertson SA. AAHA/AAFP pain management guidelines for dogs and cats. J Feline Med Surg 2007;9:466-80.
- Capner CA, Lascelles BDX, Waterman-Pearson AE: Current Bristish veterinary attitudes to perioperative analgesia for dogs. Vet Rec 1999;145:95-99.
- Wu CL, Caldwell MD.Effect of post-operative analgesia on patient morbidity. Best Pract Res Clin Anaesthesiol. 2002 Dec;16(4):549-63.
- Muir WW 3rd, Woolf CJ. Mechanisms of pain and their therapeutic implications. J Am Vet Med Assoc. 2001 Nov 15;219(10):1346-56.
- Lamont LA. Multimodal pain management in veterinary medicine: the physiologic basis of pharmacologic therapies. Vet Clin North Am Small Anim Pract. 2008 Nov;38(6):1173-86.
- Lamont LA. Adjunctive analgesic therapy in veterinary medicine. Vet Clin North Am Small Anim Pract. 2008 Nov;38(6):1187-203.
- Kongara K, Chambers P, Johnson CB. Glomerular filtration rate after tramadol, parecoxib and pindolol following anaesthesia and analgesia in comparison with morphine in dogs. Vet Anaesth Analg. 2009 Jan;36(1):86-94.
- Chambers JP, Waterman AE, Livingston A. The effects of opioid and alpha 2 adrenergic blockade on non-steroidal anti-inflammatory drug analgesia in sheep. J Vet Pharmacol Ther. 1995 Jun;18(3):161-6.
- Ochi T, Jobo-Magari K, Yonezawa A, Matsumori K, Fujii T. Anti-inflammatory and analgesic effects of a novel pyrazole derivative, FR140423. Eur J Pharmacol. 1999 Jan 22;365(2-3):259-66.
- Day TK, Pepper WT, Tobias TA, Flynn MF, Clarke KM. Comparison of intra-articular and epidural morphine for analgesia following stifle arthrotomy in dogs. Vet Surg. 1995 Nov-Dec;24(6):522-30.
- Wagner AE, Walton JA, Hellyer PW, Gaynor JS, Mama KR. Use of low doses of ketamine administered by constant rate infusion as an adjunct for postoperative analgesia in dogs. J Am Vet Med Assoc. 2002 Jul 1;221(1):72-5.
- Smith LJ, Bentley E, Shih A, Miller PE. Systemic lidocaine infusion as an analgesic for intraocular surgery in dogs: a pilot study. Vet Anaesth Analg. 2004
Auteur
 Christophe BILLE
Christophe BILLE
Docteur vétérinaire
CHV des cordeliers
77100 MEAUX