D’un diagnostic souvent aisé, les ulcères superficiels chroniques de la cornée opposent néanmoins une véritable difficulté à cicatriser.
Dans la littérature, un grande diversité de solutions thérapeutiques est proposée avec des taux de réussite variables.
Les récentes études sur l’étiopathogénie de l’affection orientent le traitement vers l’utilisation d’inhibiteurs de protéases.
Qu’est ce qu’un ulcère superficiel chronique ?
L’ulcère superficiel chronique, également appelé ulcère atone, ulcère du Boxer ou ulcère à bords décollé, est défini comme une perte de substance épithéliale évoluant depuis plus de 10 jours.
En France, bien qu’il apparaisse préférentiellement chez les jeunes boxers, retrievers, caniches et épagneuls bretons, il peut affecter les chiens de toutes races et de tous âges 14, 20, 40.
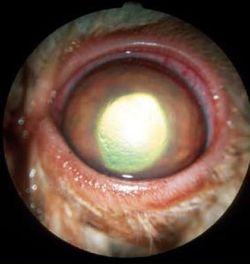
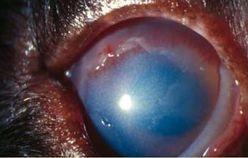
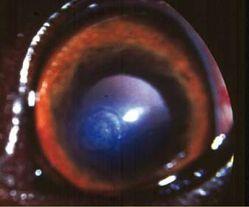

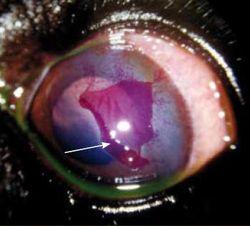
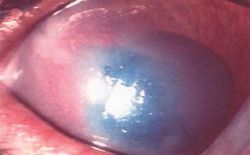
Parfois asymptomatique, parfois très douloureux, il se présente comme une plage granuleuse et dépolie à la surface de la cornée (Photo 1).
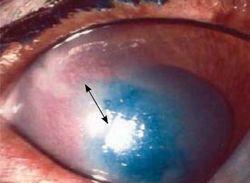
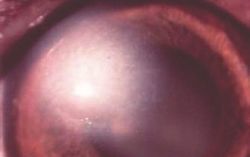
Elle est généralement entourée d’un lambeau épithélial non-adhérent (Photo 2)
La rupture de la barrière épithéliale peut générer un œdème modéré et souvent circonscrit dans le lit de l’ulcère (Photos 3 et 4).
Une néovascularisation périphérique est parfois visible près du limbe cornéen 23 (Photo 2).
Le diagnostic est fondé sur la coloration des cellules épithéliales dégénérées par un colorant vital lipophile : le vert de lissamine(Photos 5 et 6).
En raison des remaniements de la membrane basale sous-épithéliale, les colorants hydrophiles comme la fluorescéine pénètrent et colorent le stroma sous-jacent et permettent également un diagnostic.
Comment l’ulcère épithélial apparaît-il ?
La perte épithéliale est classiquement qualifiée d’idiopathique : souvent, aucune cause mécanique (anomalie ciliaire, malposition palpébrale) ou fonctionnelle (insuffisances lacrymales qualitatives et quantitatives, œdème chronique, infection, kératite à médiation immune, paralysie du trijumeau, etc.) n’est mise en évidence 6.
En conséquence, l’hypothèse d’une dystrophie épithélio-basale est avancée.
Lors d’érosion épithéliale traumatique, l’histologie révèle des cellules basales disloquées sans altération de la membrane basale, alors que celle-ci apparaît discontinue, effilochée et épaissie lors d’ulcère superficiel chronique1, 8 (Photos 7 et 8).
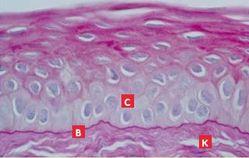
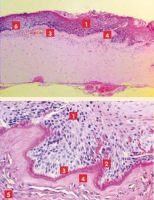
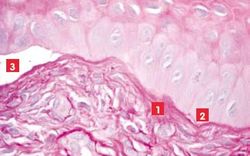
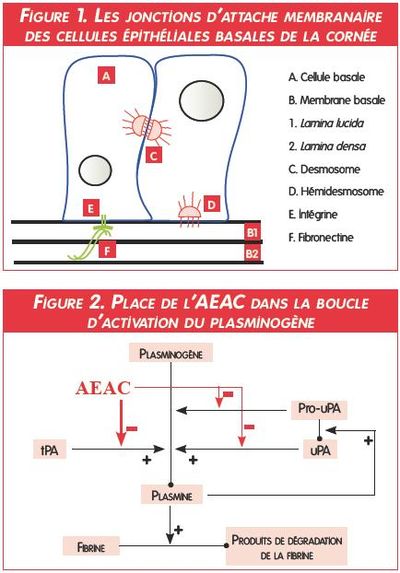
Le lambeau épithélial, hyperplasique, montre des cellules basales dégénérées qui perdent leurs hémidesmosomes et leurs jonctions cellulaires. Au niveau de ces jonctions d’attache, une substance amorphe qui s’accumule en vésicules cytoplasmiques est mise en évidence (Photos 8, 9 et 10).
Dans le stroma antérieur sous-jacent, des kératocytes apoptotiques* sont accompagnés d’une fibroplasie hyaline et d’une modification de l’innervation 26. Ces images alimentent la controverse mais ne permettent pas de conclure définitivement au caractère dystrophique de la lésion ni à son origine, épithéliale ou basale.
Pourquoi l’ulcère superficiel persiste-t-il ?
Les faibles taux épithéliaux de certains neuropeptides (substance P)26 et facteurs de croissance (TGF ß-2)18, 39 pourraient orienter l’étiopathogénie vers une carence trophique7. Bien que la cicatrisation s’accompagne d’un retour à des valeurs usuelles, aucune étude n’a pu cependant démontrer que cette diminution était spécifique à cette affection.
Au contraire, l’augmentation des taux lacrymaux de certains acteurs de protéolyse (facteur d’agrégation plaquettaire5, 31, plasmine34, 41, 44, 47) déséquilibre l’homéostasie constituée par les protéases et leurs inhibiteurs3. Ainsi, la dégénérescence des cellules épithéliales et l’apoptose* des kératocytes46 pourraient conduire à une diminution de la libération de facteurs de croissance, modulateurs de métalloprotéases matricielles (MMP). Les taux élevés de MMP 2, 3 et 9 aboutiraient à la destruction du collagène IV, constituant majoritaire des hémidesmosomes. Cette hypothèse serait alors compatible avec l’accumulation de la substance osmophile amorphe décrite à l’examen anatomopathologique.
Outre son rôle essentiel dans l’induction d’une libération accrue de collagénases, la forte augmentation du taux lacrymal de plasmine est en particulier, à l’origine d’une fibrinolyse majeure9. Dans le processus d’épithélialisation, celleci limite la migration et l’adhésion des cellules basales15.
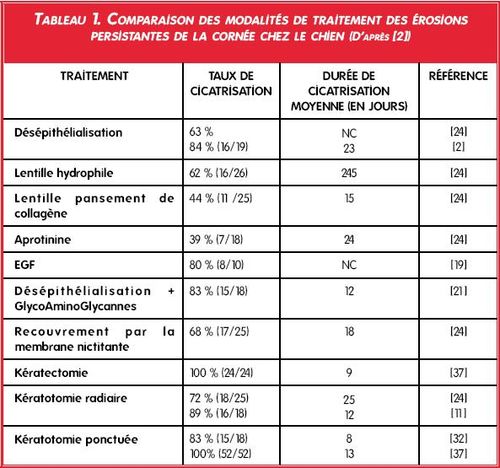
Quel traitement proposer ?
(Tableau 1)
Des gestes chirurgicaux
- Le premier geste thérapeutique face à un ulcère superficiel chronique est la désépithélialisation. Après anesthésie locale, l’épithélium non adhérent, hyperplasique et dégénéré, est débridé avec un écouvillon pour permettre l’ancrage d’un nouvel épithélium migrant sain. Renouvelable à volonté, cette technique seule permet 63 % à 84 % de cicatrisation en 3 semaines 2, 24.
- En mettant l’épithélium migrant à l’abri du mouvement abrasif des paupières, les mesures de recouvrement de l’ulcère permettent de conserver une meilleure adhésion au stroma sous-jacent :
- la greffe conjonctivale ou de biomatériaux (sous-muqueuse intestinale de porc, membrane amniotique, etc.) offre la sécurité de guérison avec l’inconvénient d’une chirurgie lourde et onéreuse ;
- la lentille hydrophile ou de collagène, la colle chirurgicale, la fixation de la membrane nictitante ou la blépharoraphie offrent en monothérapie des résultats variables, de 40 à 70 % de cicatrisation, qui peuvent être optimisés par une chirurgie du stroma ou par un traitement médical.
- Les chirurgies du stroma visent en effet à créer des points d’ancrage pour l’épithélium migrant. L’effraction de la couche hyaline antérieure peut être réalisée manuellement11, 43, par diathermie ou par laser Nd-YAG. Grâce à leur caractère peu invasif et répétable, ces techniques aboutissent à une cicatrisation dans 72 % à 100 % des cas selon certains auteurs37.
- De façon plus radicale, la kératectomie lamellaire, manuelle ou au laser Excimer, permet l’exérèse de toute la zone lésée. Souvent associée à une technique simple de recouvrement, elle offre 100 % de réussite37.
*Apoptose : terme employé ici dans sa valeur descriptive. L’application de la définition exacte de mort cellulaire programmée reste à prouver.
Des prescriptions médicales
Le traitement médical est classiquement fondé sur l’administration d’antibiotiques, de mydriatiques, de gels bioadhésifs et parfois de collyres hyperosmotiques. À l’heure actuelle, des traitements s’attachent de façon plus spécifique à trouver des bases raisonnées dans la physiopathogénie des ulcères épithéliaux chroniques.
Pour répondre aux hypothèses de carences trophiques, des collyres à base de facteurs de croissance ont été expérimentés pour renforcer les processus de migration et d’adhésion épithéliales : EGF, TGF ß-2, PDGF, GM-CSF, KGF, EDGF, IGF et sérum autologue 22, 25, 30, 35, 36, 42. Leur efficacité, variable, pourrait atteindre 80 % pour l’EGF. Les collyres de substance P n’ont montré leur efficacité à 75 % qu’en synergie avec l’IGF 26, 27, 29.
En pratique, seul le sérum autologue semble aisé d’utilisation, malgré une conservation réfrigérée limitée à 48 h. Dans l’hypothèse d’une activité protéolytique exacerbée, des collyres de fibronectine10, 16, éventuellement potentialisée par du hyaluronate, ont été essayés mais se sont révélés inefficaces face à la surproduction de protéases.
Le traitement médical s’oriente donc aujourd’hui vers des molécules anti-protéolytiques : glycosaminoglycanes polysulfatés21, bacitracine, aprotinine, acide e-aminocaproïque (AEAC)4, 12, 48, etc.
Dans une étude récente33, un collyre d’AEAC à 3,57 %13 administré 3 fois par jour en association avec une désépithélialisation a permis la cicatrisation de 94 % des ulcères en 3 semaines (Photos 11 et 12). En inhibant le tPA (tissue plasminogen activator)17, cet analogue de la lysine conduit à une diminution de la synthèse de plasmine38, 45. Il modère ainsi la libération de collagénases et augmente la synthèse de fibrine et de fibronectine nécessaires à la migration et à l’adhésion épithéliales (Figures 1 et 2).
En diminuant l’activité protéolytique des larmes, l’administration de gel bioadhésifs contenant du hyaluronate trouve alors toute sa justification en restructurant le lit de migration épithéliale28.
Quel est le pronostic de cette affection ?
Les récidives à moyen terme sur le même œil ou sur l’œil adelphe ne sont pas rares et peuvent être expliquées par l’hypothèse d’une dysplasie épithélio-basale.
Les récidives à court terme en lieu et place de l’ulcère sont justifiées par un processus de cicatrisation modifié.
Lors de simple érosion de surface, l’épithélium adhère fortement à la membrane basale sous-jacente à mesure de sa progression, jusqu’à cicatrisation complète. Au contraire, lors d’ulcère superficiel chronique, la membrane basale n’est régénérée que secondairement par l’épithélium ayant déjà cicatrisé grâce aux effractions de la couche hyaline stromale antérieure. Une bonne adhérence n’est ainsi retrouvée qu’après plusieurs mois. Cette observation impose un maintien de gels bioadhésifs pendant plusieurs semaines pour limiter l’effet abrasif des mouvements palpébraux.
Conclusion
Sans infirmer les hypothèses de carences en substance P ou TGF ß-2, ni les hypothèses de synthèse accrue de facteur d’agrégation plaquettaire (PAF), le succès thérapeutique de l’AEAC confirme le rôle essentiel de la plasmine dans l’entretien de la perte épithéliale lors d’ulcère superficiel chronique.
Avant d’envisager une kératectomie sécuritaire, le praticien peut donc proposer une alternative médicale sur 3 semaines, basée sur l’administration d’AEAC 3 fois par jour associé à du hyaluronate au coucher.
À J0, J7 et J14, une désépithélialisation et une kératotomie ponctuée seront réalisées si l’ulcère persiste.
La chirurgie sera envisagée à J21 le cas échéant.
Bibliographie
- AITKEN DA, BEIROUTY ZA, LEE WR. – Ultrastructural study of the corneal epithelium in the recurrent erosion syndrome. British Journal of Ophthalmology. 1995;79:282-289.
- ANDREW SE, GELATT KN. – Erosions persistantes de la cornée chez le chien. Waltham Focus. 2001;11:10-15.
- BARLATI S, MARCHINA E, QUARANTA CA et coll. – Analysis of fibronectin, plasminogen activators and plasminogen in tear fluid as markers of corneal damage and wound repair. Experimental Eye Research. 1990;51:1-9.
- BAUDOUIN C. – Essai clinique contrôle, randomisé en double insu, d’efficacité et de tolérance, Hexalense versus sérum physiologique, dans le traitement du syndrome de sècheresse oculaire. Rapport d’essai clinique. Neuilly-sur-Marne : Leurquin- Mediolanum. 1998:42p.
- BAZAN HEP, OTTINO P. The role of platelet-activating factor in the corneal response to injury. Progress in Retinal and Eye Research. 2002;21:449-464.
- BENTLEY E. – Pathogenesis of spontaneous chronic corneal epithelial defects in dogs. Dans : VII ièmes Journées d’actualités. Toulouse, France, 27-28-29 septembre 2002. Société Française d’Etude et de Recherche en Ophtalmologie Vétérinaire. 2002:23-28.
- BENTLEY E. – Spontaneous chronic corneal epithelial defects in dogs: what to do when erosions won’t heal. Dans : VII ièmes Journées d’actualités. Toulouse, France, 27-28-29 septembre 2002. Société Française d’Etude et de Recherche en Ophtalmologie Vétérinaire. 2002:53-58.
- BENTLEY E, CAMPBELL S, WOO HM et coll. – The effect of chronic corneal epithelial debridement on epithelial and stromal morphology in dogs. Investigative Ophthalmology and Visual Science. 2002;43:2136-2142.
- BERMAN M, LEARY R, GAGE J. Evidence for role of the plasminogen activator – plasmin system in corneal ulceration. Investigative Ophthalmology and Visual Science. 1980;19:1204- 1221.
- BOISJOLY HM, BEAULIEU A. – Topical autologous fibronectin in patients with recurrent corneal epithelial defects. Cornea. 1991;10:483-488.
- CHAMPAGNE ES, MUNGER RJ. – Multiple punctate keratotomy for the treatment of recurrent epithelial erosions in dogs. Journal of the American Animal Hospital Association. 1992;28:213-216.
- DURSUN D, KIM MC, SOLOMON A et coll. Treatment of recalcitrant recurrent corneal erosions with inhibitors of matrix metalloproteinase-9, doxycycline and corticosteroïds. American Journal of Ophthalmology. 2001;132:8-13.
- FOUSSARD-BLANPIN O, BRETAUDEAU J. – Etude pharmacodynamique d’un inhibiteur de la fibrinolyse : l’acide epsilon amino-caproïque. Anesthésie – Analgésie – Réanimation. 1965;22:481-513.
- GELATT KN, SAMUELSON DA. – Recurrent corneal erosions and epithelial dystrophy in the Boxer dog. Journal of the American Animal Hospital Association. 1982;18:453-460.
- GIPSON IK, SPURR-MICHAUD S, TISDALE A et coll. – Reassembly of the anchoring structures of the corneal epithelium during wound repair in the rabbit. Investigative Ophthalmology and Visual Science. 1989;30:425-434.
- GORDON JF, JOHNSON P, MUSCH DC et coll. – Topical fibronectin ophtalmic solution in the treatment of persistent defects of the corneal epithelium. American Journal of Ophthalmology. 1995;119:281-287.
- HAYASHI K, BERMAN M, SMITH D et coll. Pathogenesis of corneal epithelial defects : role of plasminogen activator. Current Eye Research. 1991;10:381-398.
- JURK I, GILGER B, MALOK E et coll. – TGFß-2 levels in tears of normal dogs and dogs with refractory corneal ulcers. In: 31st Annual Meeting of the American College of Veterinary Ophthalmologists. Montréal, Canada. 2000:10-13. Veterinary Ophthalmology. 2000;3:256.
- KIRSCHNER SE, BRAZZELL RK, STERN ME et coll. – The use of topical epidermal growth factor for treatment of nonhealing corneal erosions in dogs. Journal of the American Animal Hospital Association. 1991;27:449-452.
- KIRSCHNER SE, NIYO Y, BETTS DM. – Idiopathic persistent corneal erosions: clinical and pathological findings in 18 dogs. Journal of the American Animal Hospital Association. 1989;25:84-90.
- MILLER WW. – Using polysulfated glycoaminoglycan to treat persistent corneal erosions in dogs. Veterinary Medicine. 1996;91:916-922.
- MISHIMA H, NAKAMURA M, MURAKAMI J et coll. – Transforming growth factor-beta modulates effects of epidermal growth factor on corneal epithelial cells. Current Eye Research. 1992;11:691-696.
- MOORE PA. – Diagnosis and management of chronic corneal epithelial defects (indolent corneal ulcerations). Clinical Techniques in Small Animal Practice. 2003;18:168-177.
- MORGAN RV, ABRAMS KL. – A comparison of six different therapies for persistent corneal erosions in dogs and cats. Veterinary and Comparative Ophthalmology. 1992;4:38-43.
- MURALI S, HARDTEN DR, DEMARTELAERE S et coll. – Effect of topically administered platelet-derivated growth factor on corneal wound strengh. Current Eye Research. 1994;13:857- 862.
- MURPHY CJ, MARFURT CF, MCDERMOTT A et coll. – Spontaneous chronic corneal epithelial defects (SCCED) in dogs: clinical features, innervation and effect of topical SP, with or without IGF-1. Investigative Ophthalmology and Visual Science. 2001:42;2252-2261.
- NAGANO T, NAKAMURA M, NAKATA K et coll. – Effects of substance P and IGF-1 in corneal epithelial barrier function and wound healing in a rat model of neurotrophic keratopathy. Investigative Ophthalmology and Visual Science. 2003;44:3810- 3815.
- NAKAMURA M, NISHIDA T, HIKIDA M et coll. – Combined effects of hyaluronan and fibronectin on corneal epithelium wound closure of rabbit in vivo. Current Eye Research. 1994;13:385-388.
- NAKAMURA M, NISHIDA T, OFUJI K et coll. – Synergistic effect of substance P with epidermal growth factor on epithelial migration in rabbit cornea. Experimental Eye Research. 1997;65:321-329.
- NISHIDA T, NAKAMURA M, MURAKAMI J et coll. – Epidermal growth factor stimulates corneal epithelial cell attachment to fibronectin through a fibronectin receptor system. Investigative Ophthalmology and Visual Science, 1992;33:2464-2469.
- OTTINO P, TAHERI F, BAZAN HEP. – Platelet-activating factor induces the gene expression of TIMP-1, -2, and PAI-1: imbalance between the gene expression of MMP-9 and TIMP-1 and -2. Experimental Eye Research. 2002;74:393-402.
- PICKETT JP. – Treating persistent corneal erosions with a crosshatch keratotomy technique. Veterinary Medicine. 1995:561-570.
- REGNIER A, CAZALOT G, CANTALOUBE, B. – Topical treatment of non-healing corneal epithelial ulcers in dogs with aminocaproic acid. Vet Rec. 2005;157(17):510-513.
- SALONEN EM, TERVO T, TORMA E et coll. – Plasmin in tear fluid of patients with corneal ulcers: basis for new therapy. Acta Ophtalmologica. 1987;65:3-12.
- SCHULTZ G. – Future developments in corneal therapy: growth factors. In: ZIMMERMAN, T.J.Textbook of Ocular Pharmacolog y. 1st ed.Philadelphia: Lippincott-Raven Publishers. 1997:675-678.
- SINGH G, FOSTER CS. – Growth factors in treatment of nonhealing corneal ulcers and recurrent erosions. Cornea. 1989;8:45-53.
- STANLEY RG, HARDMAN C, JOHNSON BW. – Results of grid keratotomy, superficial keratectomy and debridement for the management of persistent corneal erosions in 92 dogs. Veterinary Ophthalmology. 1998;1:233-238.
- SUN Z, CHEN Y, WANG P. et coll. – The blockage of the high-affinity lysine binding sites of plasminogen by EACA significantly inhibits prourokine- induced plasminogen activation. Biochimica et Biophysica Acta. 2002;1596:182- 192.
- SWANK A, HOSGOOD G. – Corneal wound healing and the role of growth factors. The Compendium in Continuing Education for the Praticing Veterinarian. 1996;18:1007- 1018.
- TAYLOR MM. – Indolent corneal erosions. In: KIRK, R.W. (ed.)Kirk’s Current Veterinary Therapy: Small Animal Practice XII ed. Philadelphia: Saunders Company. 1995:1242-1245.
- TERVO T, VAN SETTEN GB, ANDERSSON R et coll. – Contact lens wear is associated with the appearance of plasmin in the tear fluid- preliminary results. Graefes Archives of Clinical and Experimental Ophthalmology. 1989;227:42-44.
- TSUBOTA K, GOTO E, SHIMMURA S et coll. – Treatment of persistent corneal epithelial defect by autologous serum application. Ophthalmology. 1999;106:1984-1989.
- TURNER AG, BLOGG JR. – Multiple striate keratotomy: a treatment for corneal erosions caused by epithelial basement membrane disease. Australian Veterinary Journal. 1997;75:27- 30.
- VAN SETTEN GB, SALONEN EM, VAHERI A et coll. – Plasmin and plasminogen activator activities in tear fluid during corneal wound healing after anterior keratectomy. Current Eye Research. 1989;8:1293-1298.
- WANG HM, BERMAN M, LAW M. – Latent and active plasminogen activator in corneal ulceration. Investigative Ophthalmology and Visual Science. 1985;26:511-524.
- WHITEMAN AL, BENTLEY E, ABRAMS GA et coll. – The role of apoptosis in keratocyte death in dogs with spontaneous chronic corneal epithelial defects and in dogs undergoing repeated corneal epithelial debridement. In: 32nd Annual Meeting of the American College of Veterinary Ophthalmologists. Sarasota, Florida, USA, October 10-13, 2001. Veterinary Ophthalmology. 2001;4:291-292.
- WILLEFORD KO, MILLER WW, ABRAMS KL et coll. – Modulation of proteolytic activity associated with persistent corneal ulcers in dogs. Veterinary Ophthalmology. 1998;1:5-8.
- WILLIAMS PB, CROUCH Earl R, CROUCH Jr. et coll. – Topical aminocaproic acid facilitates reepithelialisation of persistent epithelial defects. Current Eye Research. 1999;18:150- 157.
Auteur
Dr. Guillaume CAZALOT
Docteur vétérinaire
Clinique Vétérinaire La Borde rouge,
150 r. Edmond Rostand
31200 Toulouse.
Crédit des photographies
- A. Régnier (photos 1-2-4-5)
- G. Cazalot (photos 3-6-11-12)
- I. Raymond (photos 7-8-9-10)