La cardiomyopathie restrictive féline (CMR) est une maladie acquise du myocarde du chat ; plus exactement, elle regroupe plusieurs affections ayant pour caractéristique commune une dysfonction diastolique marquée sans altération majeure de la fonction systolique.
Le terme « restrictif » fait référence à des caractéristiques fonctionnelles plus qu’anatomiques, mais l’étiologie de la maladie reste largement inconnue.
Introduction
La CMR provoque une baisse de compliance et d’élasticité des parois ventriculaires, empêchant le bon remplissage diastolique et réduisant la quantité de sang acceptée par le ventricule gauche (VG).
Pendant la phase de remplissage rapide, la pression diastolique du ventricule gauche augmente brutalement, s’opposant à l’admission de sang supplémentaire, notamment pendant la phase diastolique tardive associée à la contraction atriale.
Il s’ensuit en retour une augmentation de la pression atriale gauche et une dilatation atriale gauche (ou bi-atriale).
Anatomiquement, la cardiomyopathie restrictive est caractérisée par un aspect normal ou quasi-normal des ventricules et par une légère augmentation de l’épaisseur du septum interventriculaire et de la paroi libre (postérieure) du VG, contrastant avec la dilatation atriale prononcée ; ces anomalies, les diamètres et volume normaux ou quasi-normaux de la cavité du VG, et la fonction systolique quasi-normale excluent d’autres cardiomyopathies.
L’aspect échocardiographique des cavités cardiaques sur les images statiques en 2D des chats souffrant de cardiomyopathie restrictive débutante (c’est à dire sans modifications anatomiques évidentes) peut être normal. Toutefois, une dysfonction diastolique sévère peut s’observer sur les images en mode TM et Doppler.
Récemment, le Doppler a été utilisé pour identifier les toutes premières anomalies de la fonction diastolique2 à l’aide des recommandations établies en cardiologie humaine3.

Points clefs
- La cardiomyopathie restrictive féline est une maladie acquise caractérisée par une dysfonction diastolique marquée sans altération significative de la fonction systolique.
- La baisse de compliance ventriculaire et l’augmentation des pressions de remplissage sont responsables des signes cliniques d’insuffisance cardiaque congestive gauche.
- Le diagnostic est à la fois délicat et complexe et repose sur l’interprétation croisée des résultats de l’examen clinique et des examens complémentaires.
- La cardiomyopathie restrictive féline se traduit par une physiologie restrictive sans modifications marquée de la taille des parois ou des cavités ventriculaires ; cependant, une dilatation marquée de l’atrium gauche ou des deux atriums est observée.
Étiologie
Chez l’Homme, la cardiomyopathie restrictive est plus souvent secondaire à une affection systémique (amyloïdose, sarcoïdose…) ou une irradiation, la maladie étant localisée au myocarde ou à l’endomyocarde. Chez le chat aussi, il existe les formes myocardique et endomyocardique.
La forme myocardique est typiquement non-infiltrante, avec peu ou pas d’épaississement de la paroi ventriculaire. La forme endomyocardique est caractérisée par une infiltration progressive de tissu fibreux, surtout dans le ventricule gauche, provoquant des adhérences de l’endocarde, qui montre un aspect irrégulier4.
L’étiologie est largement méconnue, bien que la littérature décrive des fibroses endomyocardiques associées à des affections virales, hyperéosinophiliques et immunitaires.

Physiopathologie
Comme nous l’avons déjà vu, les cavités ventriculaires sont de taille soit normale, soit légèrement diminuée ou augmentée (notamment lors de pathologie infiltrante), mais ont une capacité de remplissage diastolique limitée par la compliance réduite et la rigidité des parois ventriculaires. En temps normal, la diastole se divise en quatre phases successives, toutes régulées par des mécanismes actifs :
- Relaxation isovolumétrique
- Remplissage ventriculaire rapide
- Diastase (remplissage ventriculaire lent)
- Contraction atriale
Le remplissage ventriculaire est déterminé par la relaxation ventriculaire, la compliance ventriculaire, la contraction atriale et le gradient de pression intraventriculaire5. Ce dernier est l’un des facteurs responsables du mécanisme actif d’aspiration dans le ventricule normal ; le mouvement apical de détorsion qui a lieu en début de diastole entraîne une aspiration qui contribue au remplissage ventriculaire.
Ce mécanisme est significativement altéré et réduit lors de cardiomyopathie. La baisse de compliance ventriculaire et de mobilité de la paroi du ventricule gauche est à l’origine d’une augmentation de la pression diastolique finale, avec dilatation de l’atrium gauche et augmentation des pressions atriale gauche et vasculaires pulmonaires, entraînant une insuffisance cardiaque congestive gauche6.
La tachycardie aggrave encore le tableau car elle diminue le débit coronaire ; la baisse de perfusion du myocarde en stimule la fibrose, qui intensifie encore la rigidité myocardique.
En outre, la hausse de pression dans l’atrium gauche et sa baisse de fonction entraînent un ralentissement du flux intra-atrial et prédisposent à la formation de thrombus.
Tableau clinique
Le tableau clinique des chats souffrant de cardiomyopathie restrictive est extrêmement variable. Comme pour divers autres troubles cardiaques, il peut y avoir une longue phase préclinique sans aucun signe extérieur ; la nature sédentaire des chats n’aide pas car elle rend difficile l’identification d’une intolérance à l’effort.
Parfois, ce qui précipite l’apparition des symptômes est un événement banal induisant une libération rapide de catécholamines ; par exemple, l’hospitalisation d’un chat pour chirurgie de convenance peut provoquer une tachycardie et une augmentation des pressions systémiques.
De nombreux chats présentent un œdème pulmonaire aigu et une dyspnée sévère, pouvant masquer l’affection sous-jacente. Tout bruit de galop, arythmie ou signe d’œdème pulmonaire justifie la réalisation d’examens complémentaires afin de diagnostiquer la cardiopathie en cause.
De nombreux chats présentent une insuffisance cardiaque congestive gauche avec des signes caractéristiques incluant tachypnée/dyspnée et crépitements inspiratoires légers évocateurs d’un œdème pulmonaire. L’auscultation cardiaque peut révéler un souffle, ou être totalement normale.
Un épanchement pleural peut se développer, étouffant les bruits cardiaques et respiratoires. Dans certains cas, il peut y avoir une dilatation ou un pouls des veines jugulaires et un reflux hépatojugulaire.
Un autre tableau clinique aigu peut être dû à une thromboembolie systémique. La dilatation atriale gauche, la stase sanguine dans l’atrium gauche et la dysfonction atriale prédisposent à la formation de thrombus et à une éventuelle embolie consécutive.
Généralement, ces cas présentent une parésie ou une paralysie de l’un ou des deux membres postérieurs résultant de l’occlusion de la trifurcation aorto-iliaque.
Dans certains cas, les emboles peuvent se localiser ailleurs et entraîner des signes neurologiques complexes, une paralysie des membres antérieurs ou une ischémie rénale aiguë.
Radiographie
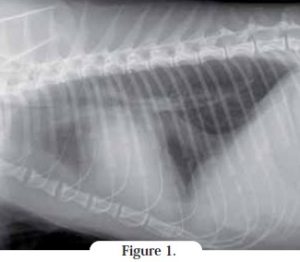
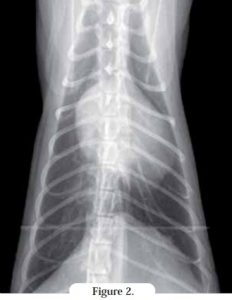
À la radiographie, une dilatation atriale (Figures 1 et 2) peut s’observer alors que les dimensions des cavités ventriculaires semblent normales. Sur la vue dorsoventrale, une image en « cœur de Saint Valentin », due à une dilatation atriale gauche ou bi-atriale marquée, peut être visible, bien que ce signe ne soit pas plus spécifique de la cardiomyopathie restrictive que d’autres cardiomyopathies.
Une congestion des vaisseaux pulmonaires, une densification de type alvéolaire/interstitiel, et la présence d’un épanchement pleural (pouvant masquer la silhouette cardiaque) peuvent compliquer le diagnostic.
Échocardiographie
L’échocardiographie est la méthode diagnostique de choix car elle permet une exploration rapide et non invasive ; grâce à elle, il est possible de mesurer les paramètres et indices de détection et d’évaluation de la dysfonction diastolique, en identifiant la cardiomyopathie responsable. D’autres cardio(myo)pathies peuvent également être exclues.
Le mode 2D et TM permet d’évaluer l’épaisseur du myocarde et peut donner des images évocatrices et caractéristiques d’une cardiomyopathie restrictive, notamment lors de dilatation marquée de l’un ou des deux atriums avec dimensions normales des cavités ventriculaires mais altération de la relaxation et de la compliance ventriculaires7.
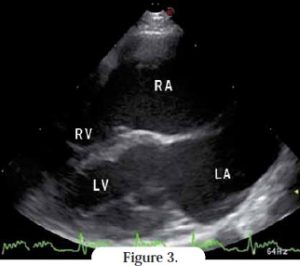
Dans l’atrium gauche, il est souvent possible d’identifier des volutes préthrombotiques, traduisant une stase sanguine ou un thrombus. La coupe parasternale droite grand axe 4 cavités met en évidence la dilatation de l’atrium gauche (et éventuellement droit) (Figures 3, 4). La taille normale ou quasi-normale des cavités et parois ventriculaires peut être confirmée ; l’absence d’hypertrophie tend à exclure d’autres cardiomyopathies. L’endocarde ventriculaire montre parfois un aspect irrégulier et hyperchogène, et peut s’hypertrophier au point de provoquer une obstruction intraventriculaire.
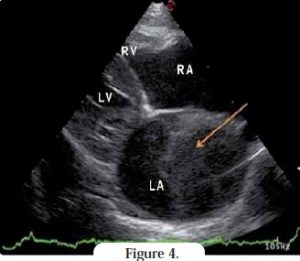
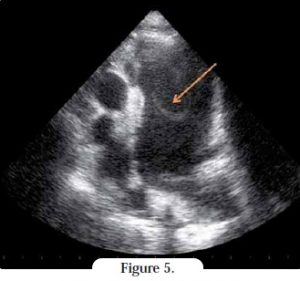
L’atrium gauche et son auricule doivent être examinés attentivement, notamment parce que la sévérité de la dilatation atriale gauche augmente le risque de thromboembolie. L’auricule gauche s’observe mieux sur la coupe crâniale gauche, en avant de l’artère pulmonaire8. Les thrombus et échocontrastes spontanés sont facilement détectables (Figure 5). Cette coupe est également utilisée pour mesurer la vélocité du flux auriculaire gauche. Même en l’absence de thrombus, si la vélocité est < 0,2 m/s sur le Doppler pulsé, le chat est à risque de complications thromboemboliques.
Le mode Doppler est important pour évaluer la fonction diastolique et identifier un profil de remplissage restrictif. Bien que difficile à obtenir chez le chat, la coupe apicale gauche 4 cavités est recommandée pour évaluer le flux transmitral et le flux veineux pulmonaire.
Le flux transmitral, ou flux mitral entrant
Il est évalué en positionnant le volume de mesure en mode Doppler pulsé entre les extrémités des feuillets de la valve mitrale ouverte.
Cela permet de caractériser le profil du flux transmitral, qui chez l’animal sain avec un rythme sinusal, montre deux phases de remplissage :
- L’onde E (remplissage protodiastolique), qui est une conséquence de la relaxation active du ventricule gauche, et du gradient de pression entre l’atrium et le ventricule gauches.
- L’onde A (contraction atriale), qui suit l’onde P sur l’ECG.
Notons que dans de nombreux cas, notamment lors de tachycardie marquée due à une insuffisance cardiaque congestive, les deux ondes peuvent fusionner et compliquer l’interprétation du profil du flux transmitral. Lorsque les ondes sont séparées, un profil de remplissage restrictif est mis en évidence quand (i) l’onde E mitrale a une vélocité élevée mais un temps de décélération (TD) court et (ii) l’onde A a une vélocité très faible. La vélocité de l’onde E est élevée en raison de la pression de remplissage élevée de l’atrium gauche.
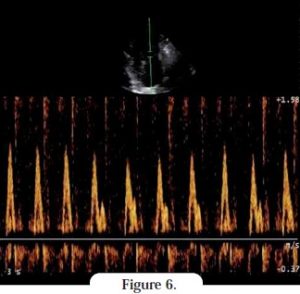
La mauvaise compliance du ventricule gauche entraîne un ralentissement brutal de ce flux. La dysfonction atriale et la mauvaise compliance du ventricule gauche expliquent à elles deux la faible vélocité de l’onde A. Les cardiologues utilisent le rapport E/A comme indice d’estimation de la fonction diastolique ; un rapport E/A > 2 confirme un remplissage restrictif (Figure 6).
Le flux veineux pulmonaire (FVP)
Il donne également des informations utiles pour l’évaluation du remplissage ventriculaire gauche, notamment lorsque les ondes mitrales E et A sont fusionnées. Le profil du FVP se décompose de la manière suivante :
- pendant la systole atriale (après l’onde P de l’ECG), il existe un flux rétrograde dirigé de l’atrium gauche vers la veine pulmonaire, produisant l’onde Ar,
- celle-ci est suivie de l’onde S, qui indique essentiellement le flux sanguin atrial pendant la systole ventriclaire (entre le complexe QRS et l’onde T) ; si le chat n’est pas tachycardie, deux ondes peuvent être visibles :
- une onde S précoce (S1) – qui indique la relaxation atriale
- et l’onde S principale (onde S tardive ou S2),
- pendant la diastole ventriculaire, quand la valve mitrale est ouverte, l’atrium gauche permet au flux veineux pulmonaire d’atteindre le ventricule gauche, produisant l’onde D.
Les signes d’un profil de remplissage restrictif incluent une onde S faible, et une vélocité élevée de l’onde D avec un temps de décélération court (Figure 7). La vélocité de l’onde Ar peut être augmentée lors de fonction atriale gauche suffisante (comme dans la Figure 7), ou diminuée lors de dysfonction atriale sévère. Si la durée de l’onde Ar est supérieure à la durée de l’onde mitrale A, cela signe une augmentation de la pression de remplissage gauche9.
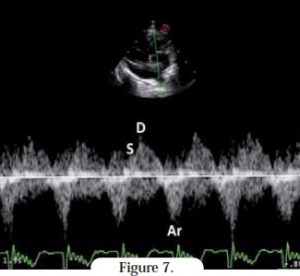
En comparant les profils des flux transmitral et veineux pulmonaire, le cardiologue peut distinguer un remplissage restrictif typique de CMR d’une autre cardiomyopathie à profil restrictif10. Un profil de remplissage restrictif avec dilatation marquée de l’atrium gauche et dimensions quasi-normales des ventricules sont les signes classiques de la CMR11.
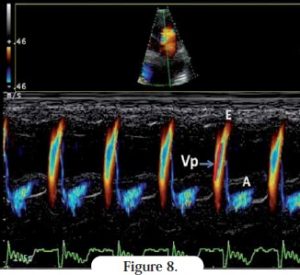
Parmi les autres méthodes actuellement utilisées chez le chat pour évaluer la fonction diastolique, il faut citer le Doppler couleur mode TM et le Doppler tissulaire.
Le Doppler couleur mode TM permet d’évaluer la vitesse de propagation du flux transmitral (Vp) ; la mesure du flux sanguin dirigé de l’anneau mitral vers l’apex définit une pente. La fonction diastolique détermine cette vitesse : plus la fonction diastolique est diminuée, moins la pente est marquée. Chez l’Homme souffrant de CMR, la Vp est réduite ; ceci n’est pas décrit dans la littérature vétérinaire mais l’auteur a observé une tendance similaire chez les chats atteints de CMR comparés aux chats sains (Figure 8).
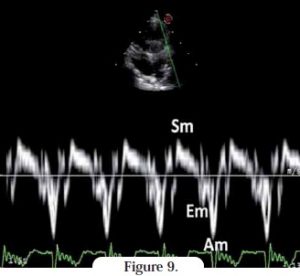
Le Doppler tissulaire est utilisé depuis peu chez le chat pour évaluer la vitesse du mouvement longitudinal des parois myocardiques pendant les différentes phases du cycle cardiaque12, 13.
Comme pour toute technique Doppler, il est essentiel d’être aligné avec les fibres longitudinales de la paroi en question. Chez les sujets sains, le profil en Doppler tissulaire montre une onde systolique positive (Sm) et deux ondes diastoliques négatives, Em (protodiastolique) et Am (télédiastolique).
Chez les animaux sains non âgés, la vélocité de l’onde Em est supérieure à celle de l’onde Am. Lors d’altération de la relaxation (en cas de cardiomyopathie restrictive féline, par exemple), la vélocité de l’onde Em peut être nettement diminuée (Figure 9)14.
En exprimant les vélocités des ondes E et Em sous forme de rapport (E/Em), il est possible d’estimer les pressions de remplissage gauches15.
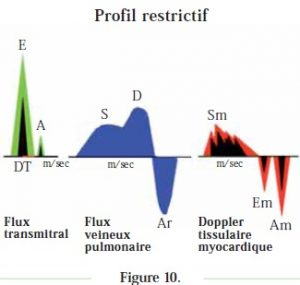
La Figure 10 résume les profils restrictifs observés avec les différentes techniques.
Pronostic et traitement
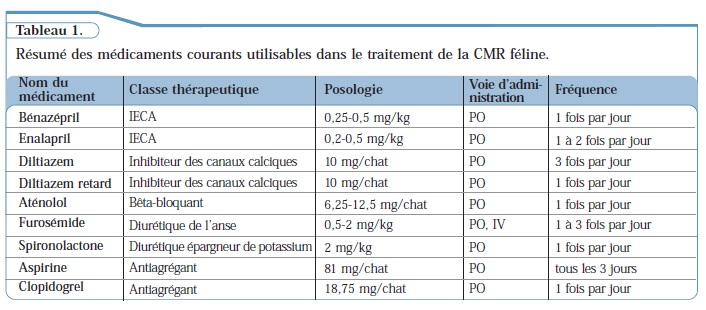
Les chats souffrant de cardiomyopathie restrictive féline sont généralement présentés à la consultation en stade déjà avancé de la maladie et leur pronostic à long terme est donc sombre. Le traitement de la cardiomyopathie restrictive féline a pour but de contrôler les signes cliniques d’insuffisance cardiaque congestive gauche, et doit être associé à un suivi radiographique et échocardiographique adapté. La prise en charge aiguë des chats dyspnéiques inclut une thoracocentèse en cas d’épanchement pleural important, et du furosémide pour l’oedème pulmonaire, administré (préférentiellement en IV) à la dose de 2-4 mg/kg toutes les 1 à 2 heures jusqu’à amélioration du tableau clinique. La poursuite du traitement dépend de la réponse clinique,mais dans l’idéal, les administrations sont espacées et, si le chat est docile, un traitement oral est mis en place. Bien qu’aucun médicament n’ait fait la preuve de son efficacité dans le traitement de la cardiomyopathie restrictive féline, il est décrit que les inhibiteurs calciques permettent d’améliorer la lusitropie (relaxation ventriculaire) et c’est souvent le traitement de premier choix. Ces chats étant à haut risque de complications thromboemboliques (surtout s’ils présentent des indicateurs échographiques de risque), un traitement antiagrégant tel que l’aspirine ou le clopidogrel doit également être envisagé (Tableau 1). Le traitement de l’insuffisance cardiaque congestive chronique chez le chat inclut le furosémide et un IECA. Le pronostic dépend aussi de la bonne volonté du chat à prendre un traitement oral, et de l’observance du propriétaire.
Conclusion
Le diagnostic de la cardiomyopathie restrictive féline nécessite une approche méthodique et il est à la fois délicat et complexe. Il repose sur l’interprétation croisée des différents profils échocardiographiques et des résultats de l’examen clinique. Ceci est indispensable à l’établissement du protocole thérapeutique et du pronostic ; ce dernier ne dépend pas uniquement de la sévérité et de la progression de l’altération structurelle du myocarde, mais aussi de la prise en charge précoce et de son efficacité.
Bibliographie
- Ferasin L. Feline myocardial disease. 1: Classification, pathophysiology and clinical presentation. J Feline Med Surg 2009;11:3-13.
- Chetboul V. Advanced techniques in echocardiography in small animals. Vet Clin North Am Small Anim Pract 2010;40:529-543.
- Mor-Avi V, Lang RM, Badano LP, et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese society of echocardiography. J Am Soc Echocardiogr 2012;24:277-313.
- Fox PR. Endomyocardial fibrosis and restrictive cardiomyopathy: Pathologic and clinical features. J Vet Cardiol 2004;6:25-31.
- Mandinov L, Eberli FR, Seiler C, et al. Diastolic heart failure. Cardiovasc Res. 2000;45:813-825.
- Paulus WJ, Tschope C, Sanderson JE, et al. How to diagnose diastolic heart failure: A consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the heart failure and echocardiography associations of the european society of cardiology. Eur Heart J 2007;28:2539-2550.
- Nagueh SF. Echocardiographic assessment of left ventricular relaxation and cardiac filling pressures. Curr Heart Fail Rep 2009;6:154-159.
- Abbott JA, MacLean HN. Two-dimensional echocardiographic assessment of the feline left atrium. J Vet Intern Med 2006;20:111-119.
- Garcia MJ, Thomas JD, Klein AL. New doppler echocardiographic applications for the study of diastolic function. J Am Coll Cardiol 1998;32:865-875.
- Tam JW, Shaikh N, Sutherland E. Echocardiographic assessment of patients with hypertrophic and restrictive cardiomyopathy: Imaging and echocardiography. Curr Opin Cardiol 2002;17:470-477.
- Rossvoll O, Hatle LK. Pulmonary venous flow velocities recorded by transthoracic doppler ultrasound: Relation to left ventricular diastolic pressures. J Am Coll Cardiol 1993;21:1687-1696.
- Carlos Sampedrano C, Chetboul V, Mary J, et al. Prospective echocardiographic and tissue doppler imaging screening of a population of Maine coon cats tested for the a31p mutation in the myosin-binding protein c gene: A specific analysis of the heterozygous status. J Vet Intern Med. 2009;23:91-99.
- Chetboul V. Doppler myocardial tissue imaging: A new promising echocardiographic technique. Schweiz Arch Tierheilkd 2003;145: 416-423.
- Nagueh SF, Middleton KJ, Kopelen HA, et al. Doppler tissue imaging: A noninvasive technique for evaluation of left ventricular relaxation and estimation of filling pressures. J Am Coll Cardiol 1997;30:1527-1533.
- Chetboul V. Tissue doppler imaging: A promising technique for quantifying regional myocardial function. J Vet Cardiol 2002;4:7-12.
Auteures
 Dr. Danitza Pradelli,
Dr. Danitza Pradelli,
Docteur Vétérinaire, PhD
Clinique Vétérinaire Gran Sasso,
Milan, Italie
Le Dr Pradelli est diplômée de médecine vétérinaire en 1999 et obtient son PhD en santé animale en 2005. Elle est ensuite professeur de pharmacologie clinique et thérapeutique à la Clinique des Maladies Cardiovasculaires de l’Université de Parme et publie de nombreux articles sur la cardiologie et l’échocardiographie vétérinaires. Elle est actuellement consultante scientifique dans une clinique privée.
 Dr. Maria Cristina Crosta,
Dr. Maria Cristina Crosta,
Docteur Vétérinaire,
Clinique Vétérinaire Gran Sasso,
Milan, Italie
Le Dr Crosta est diplômée de médecine vétérinaire en 1982 à l’Université de Milan et obtient son Diplôme d’Endocrinologie en 1989. Pendant plusieurs années, elle exerce à plein temps en médecine féline, et travaille actuellement dans la clinique privée qu’elle a créée en 1989 à Milan. Ses domaines d’intérêt vont de la génétique du pelage des chats à la prise en charge de la reproduction féline et des maladies associées, et elle est l’auteur de plusieurs ouvrages et autres publications à destination du grand public ou des professionnels.
Photos ©Dr. Crosta