L’exploration d’une anémie grave, normocytaire, normochrome, doit suivre un cheminement précis afin d’explorer toutes les pistes diagnostiques. Depuis quelques années, les progrès des méthodes de laboratoire, et notamment l’utilisation de la PCR, ont permis de mettre en évidence des cas plus nombreux de mycoplasmose.
Cet article expose la démarche anamnestique, diagnostique et thérapeutique entreprise lors d’un cas de mycoplasmose à Mycoplasma haemofelis.
Un chat européen mâle castré âgé de 10 ans est présenté à la consultation pour une modification du comportement se manifestant par des « crises de miaulements » évoluant depuis environ deux semaines.
Les propriétaires ne rapportent aucune autre anomalie, l’appétit, la prise de boisson sont inchangés et aucun signe digestif n’a été observé. L’animal n’est pas médicalisé et il a un accès libre à l’extérieur. Aucun antécédent médical n’est rapporté.
Examen clinique et hypothèses diagnostiques
À l’examen clinique, le chat est normotherme et n’est pas déshydraté. L’examen révèle par ailleurs des muqueuses pâles mais non ictériques et un souffle systolique. La palpation abdominale est normale. Aucune douleur n’est mise en évidence lors de l’examen clinique. Compte tenu de l’anamnèse, des commémoratifs et de l’examen clinique, les hypothèses d’une hypertension artérielle systémique ou une atteinte centrale (tumeur,…) sont privilégiées.
Concernant l’hypertension artérielle, une dysendocrinie comme l’hyperthyroïdie, hyperaldostéronisme primaire et une insuffisance rénale chronique doivent être recherchées.
Examens complémentaires
L’examen du fond d’œil ne révèle pas d’élément en faveur d’une rétinopathie hypertensive.
Un bilan hémato-biochimique est réalisé ainsi qu’une mesure de pression artérielle systolique par méthode Doppler et une échocardiographie.
La PAS est dans les valeurs usuelles (150 mm de Hg). L’échocardiographie ne révèle aucun support anatomique au souffle ausculté.
L’hyperthyroïdie est également exclue : la valeur de T4 totale est en effet dans les valeurs usuelles.
L’hypothèse d’hypertension artérielle étant exclue, un bilan biochimique complet est réalisé. Il ne révèle aucune anomalie (cf. tableau 1).
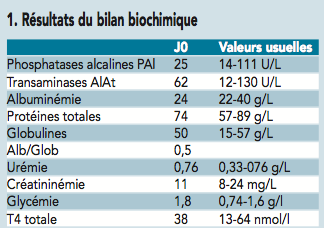
En revanche les numération et formule sanguines révèlent une anémie importante, normocytaire (VGM normal) et normochrome (CCMH normale) avec lymphocytose modérée.
L’analyse d’urines révèle une bilirubinurie, toujours pathologique chez le chat.
L’IDR (indice de distribution des globules rouges) est normal.
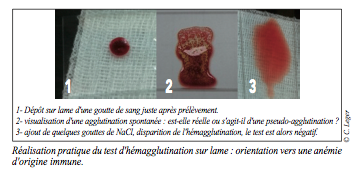
L’examen du frottis sanguin (coloration rapide Diff Quick) met en évidence une anisocytose et une polychromatophilie discrètes. Aucun sphérocyte n’est visualisé. Un test d’agglutination sur lame est effectué : il est positif (cf. photo).
À ce stade des investigations, on note une anémie marquée, normochrome, normocytaire sans atteinte des autres lignées. Un processus inflammatoire chronique semble a priori exclu et il n’y a ni insuffisance rénale, ni atteinte hépatique.
Le caractère périphérique secondaire à une hyperhémolyse avec composante immunitaire et réticulocytose est suspecté : absence de signe d’hémorragie ou de trouble de l’hémostase, agglutination sur lame, bilirubinurie, IDR limite supérieure des VU, aspect du frottis. Le test de Coombs direct est positif : il renforce la suspicion de mécanisme immunologique sous-jacent.
Le caractère régénératif est vérifié : 15 réticulocytes pour 1000 hématies ou en valeur absolue, 50 000 réticulo- cytes/µl (VU > 40 000). La régénération est qualifiée de faible (notamment face à une anémie aussi importante). Cependant, le pic de réponse médullaire étant maximum en 5 à 7 jours chez le chat, il n’est pas possible de savoir à ce moment si la moelle est atteinte ou non. Ainsi, si le caractère périphérique de l’anémie est certain, une composante centrale ne peut être exclue. La qualité de l’érythropoïèse médullaire reste donc à évaluer.
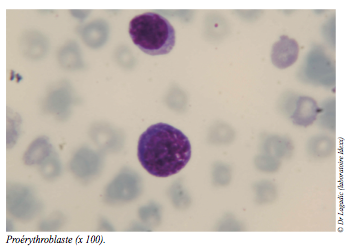
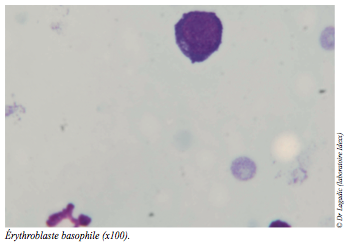
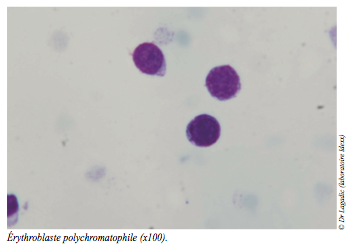
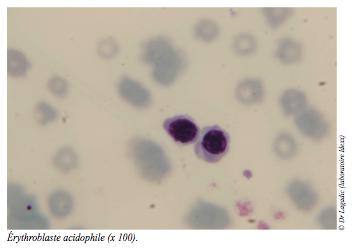
En raison du caractère hyporégénératif de l’anémie, l’analyse du myélogramme est également demandée. Les objectifs sont de confirmer ou d’infirmer un défaut qualitatif ou quantitatif d’érythropoïèse et d’en déterminer le cas échéant, l’origine.
Confirmation d’une mycoplasmose
De nouveaux prélèvements sanguins et une ponction de moelle osseuse sont réalisés 48 heures après la première consultation. Le test FeLV/FIV est négatif.
La recherche par méthode PCR des agents infectieux suivants : FeLV et mycoplasmes hémotropes (Mycoplasma haemofelis et Candidatus Mycoplasma haemominutum) est demandée. Le FeLV est recherché à partir de sang et de moelle osseuse.
Les résultats confirment la présence en grande quantité dans le sang d’ADN de mycoplasmes félins et confirment le résultat négatif obtenu par le test FeLV. L’absence du virus leucémogène au sein de la moelle osseuse est également confirmée.
Le myélogramme (cf. photos) conclut à la normalité qualitative et quantitative des lignées érythroblastiques (hyperplasie érythroïde), granulocytaires et mégacaryocytaires.
L’animal est alors revu en consultation afin de mettre en place un traitement adapté.
Son état s’est dégradé. Les muqueuses sont discrètement ictériques, son appétit a diminué, il est abattu et légèrement déshydraté.
Les numération et formule sanguines effectuées montrent une aggravation de l’anémie (cf. tableau 2).
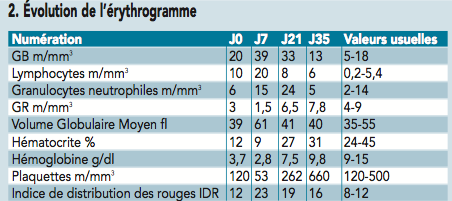
Une transfusion est proposée mais refusée par les propriétaires. Le traitement mis en place associe fluidothérapie pendant 24 heures, doxycycline 10 mg/kg/j PO et prednisone à 2 mg/kg/j PO pendant deux semaines puis à dose dégressive. Dès lors, on note une amélioration rapide de l’état général du chat. Les contrôles sanguins montrent également l’amélioration de l’érythrogramme. Le traitement antibiotique est interrompu à J35. Un contrôle sanguin un mois plus tard révèle un hématocrite normal.
À propos des anémies félines
L’anémie qu’elle soit ou non régénérative est une des anomalies hématologiques les plus fréquemment rencontrées chez le chat. Face à celle-ci, une myriade de maladies infectieuses ou non est possible.
Les anémies régénératives (donc périphériques) sont la conséquence d’hémorragie et/ou d’hémolyse pathologique ou hyperhémolyse : fragilisation de la membrane érythrocytaire menant à une destruction prématurée du GR et syndromes dysimmunitaires primitifs ou secondaires en sont les principales origines.
Les anémies par hyperhémolyse sont ainsi classables en :
- anémies infectieuses (hémoplasmose -mycoplasmes hémotropes-, cytauxzoonoses).
- anémies à médiation immune primitives ou idiopathiques.
- anémies hémolytiques à médiation immunes secondaires : FeLV, FIV, PIF, hémoplasmose, tumeur (maladies lym- phoprolifératives).
- anémies liées aux toxiques oxydants (à corps de Heinz) : paracétamol…
- anémies corpusculaires (anomalie intrinsèque du GR) : déficit en pyruvate kinase, fragilité osmotique des Abyssins et Somali.
- anémies métaboliques : hypophosphatémie grave.
Étiologie et épidémiologie
Les agents responsables des hémoplasmoses félines sont des mycoplasmes dits hémotropes qui s’observent à la surface des hématies (position péricellulaire). Leur culture in vitro n’est toujours pas possible à ce jour.
Depuis quelques années de nouvelles espèces de mycoplasmes ont été décrites.
Les trois espèces réputées pathogènes chez le chat sont :
- Mycoplasma haemofelis également appelé Haemobartonella felis, Eperythrozoon felis, Haemobartonella felis. large form (Hflg), Candidatus Mycoplasma haemofelis.
- Candidatus Mycoplasma haemominutum ou Haemobartonella felis small form (Hfsm).
- Candidatus Mycoplasma turicensis.
Mycoplasma haemofelis est l’espèce la plus importante en médecine vétérinaire. Elle possède le pouvoir pathogène le plus fort devant Candidatus Mycoplasma turicensis et Candidatus Mycoplasma haemominutum. Ces derniers sont en général facteur aggravant d’une anémie, mais il n’a pas encore été prouvé qu’ils puissent être la cause primaire d’une anémie chez un chat immunocompétent.
Une co-infection avec le FeLV peut, quant à elle, favoriser le développement d’une anémie significative. La mycoplasmose à Mycoplasma haemofelis est aussi appelée anémie infectieuse féline.
Les modes de transmission ne sont pas encore clairement élucidés. Le rôle des puces et autres arthropodes hématophages comme vecteurs est possible pour Mycoplasma haemofelis. De manière expérimentale, il a été démontré une transmission par voie orale, intraveineuse (transfusion sanguine) ou intrapéritonéale. La transmission naturelle semble s’effectuer in utero ou par morsure.
Quatre phases peuvent être décrites dans la pathogénie de l’affection.
- La période d’incubation varie de 2 à 34 jours.
- La phase aiguë de la maladie est marquée par la survenue des symptômes cliniques et des anomalies sanguines. C’est la phase parasitémique associée à la survenue de l’anémie hémolytique. Sa durée est de 2 à 4 semaines.
- Les symptômes et modifications hématologiques peuvent être très variés dans leur intensité : asthénie, anorexie, perte de poids, hyperthermie fluctuante en fonction de la parasitémie, ictère, splénomégalie, anémie. En l’absence de traitement, environ un tiers des chats meurt. Les animaux qui résistent à l’infection retrouvent un hématocrite nor- mal malgré la possibilité de trouver des parasites dans le sang.
- Enfin, il semble que tous les chats restent par la suite des porteurs sains de mycoplasmes. Certaines situations : stress, corticothérapie, maladies intercurrentes… peuvent faire réapparaître des mycoplasmes dans le sang. Cependant, l’anémie induite apparaît moins grave.
Caractérisation de l’anémie
L’anémie est la conséquence d’une hémolyse extravasculaire. Les parasites adhèrent fortement à la membrane érythrocytaire et sont ainsi responsables de sa fragilisation. Les hématies parasitées sont alors phagocytées notamment dans la rate. En phase aiguë, on observe une bilirubinurie, une bilirubinémie, un ictère. La bilirubinémie et l’ictère ne sont pas constants et dépendent de la rapidité de développement de l’hémolyse.
D’autres mécanismes associés sont suspectés. Des auto-anticorps sont formés suite à la sensibilisation des sites antigéniques lorsque la membrane érythrocytaire est lésée : l’hémolyse dysimmune survient par ce mécanisme. Le test de Coombs direct pourra alors être positif pendant cette phase de la maladie. La co-infection par le FeLV aggrave, elle aussi, par divers mécanismes, l’anémie.
Au niveau périphérique, une thrombopénie FeLV dépen- dante peut favoriser des pertes sanguines. Au niveau central, le FeLV peut induire pancytopénie, érythroblastopénie isolée, dysérythropoïèse, envahissement médullaire par une hémopathie maligne ou un autre type tumoral, et enfin myélofibrose.
La réticulocytose est normalement forte en corrélation avec la chute de l’hématocrite.
L’IDR ou indice de distribution des hématies donne une idée sur la distribution du volume des hématies et produit ainsi une évaluation quantitative de l’anisocytose. Les désordres du volume érythrocytaire ne peuvent pas toujours être déterminés en examinant le VGM. Un large pourcentage de cellules au volume altéré est requis pour obtenir un VGM anormal. Le maximum d’information sur la morphologie éry- throcytaire est donc obtenu par l’évaluation simultanée de l’érythrogramme et du frottis sanguin. De ce fait, un IDR >14 chez le CT est en général synonyme de régénération.
Sur le frottis sanguin, anisocytose et polychromatophilie sont normalement observées.
Cependant, les taux de réticulocytes peuvent être bas dans plusieurs circonstances :
Le temps de maturation des réticulocytes est plus long chez le chat que chez le chien (4 à 5 jours) et lors de co-infection par le FeLV. Le diagnostic peut se faire par visua- lisation du parasite sur un frottis sanguin réalisé juste après la prise de sang et coloré par le May-Grünwald-Giemsa ou mieux l’acridine orange (nécessité d’observation sous ultra- violets). Cependant, la sensibilité de cette méthode est fai- ble (50 %) en raison de la fluctuation de la parasitémie même en phase aiguë de la maladie et du risque de détachement des parasites épicellulaires sous l’effet de la conservation et d’anticoagulants comme l’EDTA. Candidatus Mycoplasma haemominutum et Candidatus Mycoplasma turicensis ne sont pas visibles. A l’inverse, de nombreux faux positifs sont possibles : confusion avec des corps de Howell-Joly, colorant résiduel… Le recours à la technique PCR est actuellement la méthode de choix, beaucoup plus sensible et spécifique, elle permet de reconnaître les différents mycoplasmes et d’apprécier la charge parasitaire.
Traitement, prévention et suivi des chats porteurs
La doxycycline à la dose usuelle de 10 mg/kg/j (donnée avec le repas) est utilisée chez les chats malades (symptômes cliniques et anomalies sanguines). L’apparition d’anorexie et/ou de vomissements chez le chat devra faire craindre l’apparition d’une sténose œsophagienne induite par l’antibiothérapie.
En général, l’hématocrite se normalise en deux à trois semaines. Le traitement est alors stoppé. La co-infection avec les rétrovirus minore le pronostic et les risques de rechutes sont plus importants. L’enrofloxacine (5 m/kg/jour) est une alternative possible en cas de non tolérance ou d’échec des tétracyclines.
Les chats sains pour lesquels une parasitémie est détectée par méthode PCR ne sont pas à traiter. En effet, l’élimination des parasites n’est pas possible.
Le contrôle des puces reste recommandé tout comme la limitation de l’accès à l’extérieur.
Le recours aux corticoïdes est controversé. Le risque est notamment de permettre la réactivation d’infections latentes.
Leur utilisation à dose immunosuppressive est indiquée lors de réactions dysimmunitaires périphériques et/ou centrales associées. En pratique, si un test de Coombs direct et/ou un test d’agglutination sur lame ont été réalisés et sont positifs, l’emploi des corticoïdes peut se justifier.
De même, si la monothérapie à la doxycycline n’est pas suivie d’une amélioration clinique et de l’élévation de l’hématocrite, les corticoïdes seront ajoutés. Il a cependant été démontré que des chats anémiés porteurs d’hémoplasmes et pour lesquels un test de Coombs à froid (IgM) se révèle positif, guérissent sans adjonction de corticoïdes : les anticorps (IgM) disparaissant donc après la phase aiguë de l’infection.
Auteur

Article extrait de L’Essentiel N°229 du 27 octobre au 2 novembre 2011