Le diabète sucré est une endocrinopathie fréquente chez le chat. L’incidence de cette maladie est en augmentation, certainement en raison d’une augmentation des facteurs de risque tels que l’obésité, le manque d’activité physique et l’âge.Les chiffres exacts sont difficiles à recueillir, et la partie non visible est certainement importante, mais une étude récente réalisée sur une population de chats assurés au Royaume-Uni a révélé une prévalence de 0,43 % 1
Points clefs
- La majorité des chats diabétiques souffrent d’un type de diabète similaire au diabète de type 2 de l’Homme.
- Le diagnostic est basé sur la présence de signes cliniques et d’une hyperglycémie/glycosurie persistante. L’évaluation initiale doit non seulement viser à déterminer la sévérité de la maladie mais également à rechercher la présence d’une maladie concomitante ou d’autres facteurs contributifs.
- Le traitement doit être mis en place immédiatement après le diagnostic. L’insulinothérapie et le régime alimentaire sont les pierres angulaires du traitement.
- La plupart des chats sont correctement stabilisés en l’espace de 3 mois. Si les signes cliniques persistent malgré le traitement, une investigation méthodique est recommandée.
Types de diabète
La classification traditionnelle du diabète sucré chez le chat a plus ou moins suivi le schéma utilisé en médecine humaine. Bien que les mécanismes étiopathogéniques puissent ne pas être tous identiques, cette approche sert de guide pour l’identification et la différenciation des différentes formes de la maladie. Chez l’Homme, le diabète est classé en type 1, type 2, autres types spécifiques et diabète de la grossesse.
Chez le chat, le type 1 semble être extrêmement rare. Il est aujourd’hui admis que la grande majorité (80 %) des cas de diabète félin sont de type 2 – une maladie hétérogène associant un défaut d’action de l’insuline (insulinorésistance) et une insuffisance des cellules bêta du pancréas. Pour que ces deux anomalies se développent, des facteurs environnementaux et génétiques entrent en jeu. Ces derniers n’ont pas encore été identifiés chez le chat, mais la preuve la plus convaincante de l’existence de facteurs génétiques provient des études réalisées chez le Burmese, la fréquence du diabète dans cette race s’avérant plusieurs fois supérieure à celle observée chez le chat Européen 1, 2.
Les autres facteurs de risque incluent l’âge, le fait d’être de sexe mâle, la castration/ stérilisation, le manque d’activité physique, les traitements corticoïdes et progestatifs, et l’obésité. Comme chez l’Homme, le facteur de risque le plus important est l’obésité, et il a été démontré que les chats obèses ont 3,9 fois plus de risques de développer un diabète que les chats ayant un poids optimal. Il est important de préciser que, bien que l’obésité induise une insulinorésistance, tous les chats obèses ne développent pas de diabète. Quand les cellules bêta sont saines, la réponse adaptative à l’obésité et à l’insulinorésistance consiste à augmenter la sécrétion d’insuline de façon à maintenir une tolérance normale au glucose. Toutefois, en cas de dysfonction des cellules bêta, la tolérance au glucose est altérée et un diabète de type 2 finit par se développer.Nous ignorons encore quels sont les facteurs responsables de la baisse de sécrétion d’insuline et de la progression du diabète ; parmi les hypothèses, citons le dépôt de substance amyloïde, la glucotoxicité et la lipotoxicité.
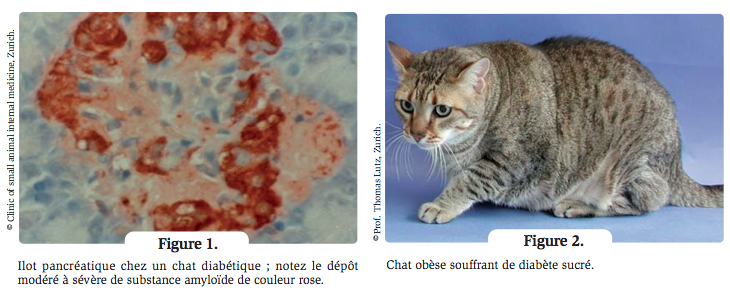
La substance amyloïde provient de l’amyline (ou polypeptide amyloïde des îlots de Langerhans), une hormone co-sécrétée avec l’insuline par les cellules bêta. Le chat est l’une des rares espèces dans laquelle l’amyline a tendance à former des feuillets bêta (encore appelés feuillets bêta plissés), qui se déposent sous forme de substance amyloïde dans les îlots pancréatiques et entraînent la destruction des cellules bêta (Figure 1).
Le concept de glucotoxicité correspond à la diminution de sécrétion d’insuline provoquée par l’hyperglycémie ; cette notion a été démontrée chez des chats sains, où la sécrétion d’insuline cessait après 3 à 5 jours d’hyper- glycémie continue. Initialement, l’inhibition de la sécrétion d’insuline est réversible, mais avec le temps, les lésions des cellules bêta deviennent permanentes.
Le concept de lipotoxicité est analogue et implique des taux élevés d’acides gras ; les preuves de l’existence de lésions des cellules bêta ne sont toutefois pas aussi convaincantes qu’avec l’hyperglycémie.
- Ces concepts sont importants à comprendre, car le traitement immédiat du diabète peut supprimer les effets toxiques du glucose et augmenter les chances de rémission.
- Les autres types spécifiques, anciennement appelés diabètes secondaires, représentent environ 20 % des cas de diabète chez le chat et incluent la pancréatite, les tumeurs pancréatiques, l’hypercorticisme, l’acromégalie et les traitements diabétogènes (progestatifs, corticoïdes). Le diabète gestationnel est peu fréquent chez le chat.
Caractéristiques des animaux et manifestations cliniques ?
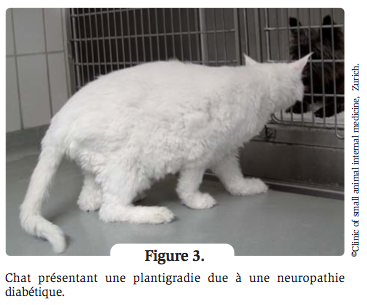
Le diabète apparaît généralement chez les chats d’âge moyen à avancé. Il existe une forte prédisposition sexuelle, les chats diabétiques étant à 70 % de sexe mâle. Environ 60 % des chats diabétiques sont en surpoids (Figure 2), 35 % ont un poids normal et 5 % sont en sous-poids 4. La majorité des chats diabétiques présentent des signes classiques de diabète, à savoir polyuropolydipsie, polyphagie et perte de poids. Environ 10 % des chats diabétiques présentent des signes visibles de neuropathie diabétique, se traduisant par une faiblesse des membres postérieurs, une aptitude diminuée au saut et une plantigradie (Figure 3).
Dans de rares cas, une faiblesse des membres antérieurs est également observée. Une léthargie et une sécheresse associée à un mauvais état du pelage sont souvent présentes, tandis qu’une hépatomégalie peut être détectée à l’examen clinique. En présence d’une affection concomitante ou sous-jacente, d’autres signes cliniques peuvent être observés. Si le diabète est compliqué (acidocétose diabétique, syndrome hyperosmolaire non cétosique), les signes suivants sont présents : léthargie, anorexie, baisse de la consommation hydrique et vomissements.
 Diagnostic et investigation
Diagnostic et investigation
Le diagnostic du diabète repose sur la présence de signes cliniques et d’une hyperglycémie/glycosurie persistante. La plupart des chats ne sont présentés à la consultation que quand leurs valeurs de glycémie ont dépassé la capacité rénale de réabsorption du glucose (~15 mmol/L soit 270 mg/dL), car c’est généralement uniquement à ce stade de la maladie que les symptômes apparaissent. La glycosurie seule ne suffit pas à établir un diagnostic de diabète, car elle peut également être due à une affection rénale, à certains médicaments ou à un stress. Il peut être difficile de différencier une hyperglycémie de stress d’une hyperglycémie diabétique. Lors de stress, l’élévation de la glycémie est souvent légère à modérée, mais des concentrations de glucose supérieures à 15 mmol/L (270 mg/dL) peuvent néanmoins être observées. Dans ce dernier cas, une glycosurie peut également être présente. L’hyperglycémie de stress peut être diagnostiquée grâce à des mesures répétées de la glycémie montrant une normalisation des taux de glucose. Certains chats, toutefois, restent stressés tant que dure l’hospitalisation avec une glycémie toujours élevée. La mesure du taux de fructosamine sérique est une méthode diagnostique alternative. La concentration de fructosamine reflète la glycémie moyenne sur la ou les deux dernière(s) semaine(s). Les normes de référence varient légèrement selon les laboratoires mais se situent généralement autour de 200-360 μmol/L. Dans la grande majorité des cas de diabète félin récemment diagnostiqués, les taux de fructosamine sont supérieurs à 400 μmol/L et atteignent parfois 1500 μmol/L. La fructosaminémie n’étant pas influencée par les augmentations temporaires de la glycémie, ses valeurs sont généralement normales lors d’hyperglycémie de stress 5. En revanche, les concentrations de fructosamine peuvent s’avérer normales en cas de diabète récent et lors d’hyperthyroïdie ou d’hypoprotéinémie concomitante.
Toute maladie concomitante risque d’aggraver l’insulinorésistance et de compromettre l’efficacité du traitement. Par conséquent, une numération-formule, un bilan biochimique, une analyse d’urine et une culture urinaire doivent systématiquement être réalisés. Parmi les anomalies hématologiques et biochimiques potentielles, citons l’anémie légère avec leucogramme de stress, l’hypercholestérolémie, et l’augmentation des PAL/ALAT. Chez la majorité des chats, la densité urinaire est supérieure à 1020, et une cétonurie est parfois observée, même dans les cas non compliqués. Une protéinurie est présente dans environ 50 % des cas et celle-ci est généralement légère à modérée, avec un rapport protéines/- créatinine urinaires inférieur à 2. Dans certains cas, une infection urinaire bactérienne est présente et une culture urinaire doit toujours être réalisée. D’autres examens diagnostiques peuvent être indiqués (ex. radiographie, échocardiographie ou échographie abdominale) en fonction des résultats des examens initiaux.
Une pancréatite est souvent associée au diabète, mais le lien de causalité entre les deux n’est pas encore élucidé. Son diagnostic est difficile car les signes cliniques sont souvent discrets et non spécifiques et les taux d’amylase et de lipase sériques ont peu de valeur diagnostique 6.
La mesure de la concentration d’insuline plasmatique ne permet pas d’identifier le type de diabète, ni de savoir s’il reste des cellules bêta qui fonctionnent permettant une éventuelle rémission. Si un hypercorticisme ou une acromégalie sont suspectés, les examens diagnostiques spécifiques ne devront être réalisés qu’après avoir quelque peu stabilisé l’animal avec l’insulinothérapie.
Traitement
L’objectif du traitement est de supprimer les symptômes, de prévenir les complications à court terme (ex. hypoglycémie, acidocétose) et ainsi de rétablir une bonne qualité de vie. Contrairement aux chiens, les chats diabétiques ont de bonnes chances de rémission avec un traitement approprié. La rémission correspond à la normalisation des taux sanguins de glucose et de fructosamine et la disparition des signes cliniques et de la glycosurie sans besoin ultérieur de traitement antidiabétique ; elle peut concerner jusqu’à 50 % des chats et s’observe généralement dans les 3 premiers mois de traitement. Le bon contrôle de la glycémie supprime l’effet de glucotoxicité ; la mise en place du traitement dès l’établissement du diagnostic permet d’augmenter les chances de rémission.
Les signes cliniques sont bien contrôlés si la glycémie est maintenue entre 5 et 15 mmol/L (90-270 mg/dL) tout au long de la journée. Les propriétaires peuvent trouver le traitement compliqué ; il est donc essentiel de leur fournir tous les détails techniques nécessaires sur la maladie et de leur assurer qu’ils peuvent vous contacter facilement en cas de besoin. Le traitement doit suivre un protocole précis et compréhensible (Tableau 1),et les instructions écrites sont d’une grande utilité.

Hypoglycémiants oraux
Comme 80 % des chats souffrent de diabète de type 2, ces médicaments peuvent en théorie être utilisés.
Actuellement, il existe 7 classes différentes d’hypoglycémiants oraux mais seules les sulfonylurées ont fait l’objet de recherches et ont démontré une efficacité significative chez le chat. Les sulfonylurées (dont le glipizide, le plus utilisé chez le chat) stimulent la sécrétion d’insuline, et leur efficacité nécessite donc une certaine fonction des cellules bêta du pancréas. Le glipizide ne doit être utilisé que chez les animaux diabétiques en bon état général, non cétosiques et dont les symptômes sont modérés. La posologie initiale est de 2,5 mg/chat 2 fois par jour, augmentée à 5 mg/chat 2 fois par jour après 2 semaines si aucun effet indésirable n’est observé et si l’hyperglycémie est toujours présente. Mais le taux de réussite n’est que de 30 % environ et le traitement peut altérer les îlots, entraînant une destruction accélérée des cellules bêta résiduelles. Le glipizide n’offrant aucun avantage médical par rapport à l’insuline, il ne doit être utilisé que dans les cas où le propriétaire s’avère incapable de réaliser les injections d’insuline.
Insulinothérapie
L’insulinothérapie et le régime alimentaire sont les pierres angulaires du traitement des chats diabétiques. Chez les chats souffrant de diabète non compliqué, les insulines de choix sont celles qui ont une durée d’action intermédiaire. Les préparations disponibles varient selon les pays, mais il existe dans de nombreux pays une insuline porcine lente avec AMM chat. Notons que chez certains chats, cette insuline a une durée d’action inférieure à 12 heures ; ce problème de courte durée d’action est effectivement bien connu chez le chat et ne concerne pas que l’insuline lente mais également d’autres types d’insuline.
Autre problème, l’absorption de l’insuline peut être variable, entraînant des valeurs de glycémie aberrantes. Ce problème existe aussi chez l’Homme et a conduit au développement récent d’analogues insuliniques ; la molécule actuellement la plus utilisée est l’insuline glargine. Ce médicament est depuis peu bien connu des propriétaires de chats diabétiques ; sa durée d’action est plus longue que celle des insulines lentes, bien que généralement inférieure à 24 h, et son administration biquotidienne permet d’obtenir un meilleur contrôle de la glycémie que l’administration quotidienne unique. La glargine pourrait constituer une alternative intéressante pour les chats chez lesquels la durée d’action de l’insuline lente est trop courte pour permettre un bon contrôle métabolique et, d’après certains auteurs, le taux de rémission obtenu avec la glargine serait supérieur à celui obtenu avec les autres types d’insuline 7. Toutefois, le nombre de cas publiés reste faible et il est donc impossible de tirer de conclusion définitive.
La préférence de l’auteur va à l’insuline lente ou à la glargine pour commencer le traitement ; bien que l’insuline PZI (Protamine Zinc Insuline) soit également un bon choix de première intention 8, cette prépa- ration est difficile à trouver dans de nombreux pays. La fréquence d’administration est toujours biquotidienne, la dose initiale étant égale à 1 U/chat à chaque injection chez le chat de moins de 4 kg, et à 1,5-2 U/chat chez le chat de plus de 4 kg. Chez les animaux présentant une glycémie < 20 mmol/L (360 mg/dL) au moment du diagnostic, la posologie ne doit pas dépasser 1 U/chat 2 fois par jour, quel que soit le poids de l’animal.
Lors du diagnostic, le chat peut être hospitalisé pendant 1 ou 2 jours pour une évaluation complète. Pendant cette période, la glycémie sera mesurée 3 à 4 fois par jour et la posologie d’insuline sera réduite si une hypo- glycémie (< 5 mmol/L – 90 mg/dL) est observée. Si la glycémie reste élevée, la posologie ne devra pas être modifiée immédiatement, car l’insuline met quelques jours à agir (période d’équilibration). La posologie sera ajustée le cas échéant lors des évaluations suivantes. La prise en charge initiale et la mise en place du traitement peuvent également se faire en ambulatoire. L’un des moments clés de la prise en charge du chat diabétique par son propriétaire est le moment où le vétérinaire explique les détails techniques du traitement. Le propriétaire doit être capable de mélanger correctement l’insuline (agiter délicatement le flacon selon un mouve- ment circulaire en évitant de le secouer ; notons que la glargine est une solution limpide qui n’a pas besoin d’être resolubilisée), de remplir la seringue sans aspirer de bulles d’air, et d’injecter le produit sous la peau du thorax. Le propriétaire doit connaître les problèmes qui peuvent éventuellement survenir (ex. douleur, saignement, injection dans le pelage), savoir comment y remédier, et savoir quand il doit consulter (signes d’hypoglycémie, réapparition de la PUPD, symptômes d’acidocétose diabétique). Le propriétaire doit être averti qu’il ne doit pas réchauffer ou congeler l’insuline, et, bien que l’insuline ne soit pas inactivée à température ambiante, que celle-ci doit être conservée au réfrigérateur. De l’expérience de l’auteur, l’insuline conserve son activité pendant plusieurs mois si elle est correctement manipulée, et le flacon ne sera remplacé que si le contrôle glycémique se dégrade sans raison apparente. Le propriétaire doit également connaître la différence entre les insulines 40 U/mL et les insulines 100 U/mL et comprendre qu’il est nécessaire d’utiliser la bonne taille de seringue. Les seringues non adaptées doivent être évitées car elles peuvent entraîner un risque d’erreur élevé.
Prise en charge nutritionnelle
Le chat est un carnivore strict, ce qui le différencie clairement du chien qui est omnivore. Le régime naturel des chats sauvages (ex. souris et oiseaux) contient moins de 10 % de glucides sur la matière sèche. Ce chiffre est très différent des pourcentages affichés par la plupart des aliments préparés pour chats, qui sont riches en glucides. Plusieurs études indiquent qu’une alimentation pauvre en glucides et riche en protéines donne un meilleur contrôle clinique et des taux de rémission supérieurs 9, 10. Ces observations coïncident avec les recommandations de l’AAHA sur le diabète sucré 11, préconisant un régime hyperprotéique (protéines représentant plus de 45 % de l’énergie métabolisable) et un apport minimal de glucides. Les aliments humides sont préférables aux aliments secs car ils sont plus pauvres en glucides et affichent une densité énergétique inférieure ; ils permettent également une meilleure gestion des quantités et favorisent la consommation hydrique 11. Etant donné que l’insulinorésistance due à l’obésité est presque totalement réversible et qu’une perte de poids même légère permet d’améliorer le contrôle métabolique, une réduction pondérale doit être fortement encouragée chez les chats en surpoids (environ 1 % de perte de poids par semaine). Néanmoins, le vétérinaire doit toujours évaluer la teneur nutritionnelle de l’aliment en fonction de l’énergie (g/1000 kcal) car les aliments humides ne sont pas tous pauvres en glucides et les aliments secs ne sont tous pas riches en glucides. En outre, certains aliments hyperprotéiques et hypoglucidiques sont également très énergétiques, ce qui peut compromettre l’efficacité du programme de contrôle pondéral. Une étude récente 12 a observé que l’absence d’activité physique et la vie en appartement pourraient être des facteurs de risque indépendants du développement du diabète chez le chat. L’heure des repas par rapport à l’administration d’insuline ne semble pas jouer un rôle crucial ; la qualité du contrôle métabolique n’est pas différente entre les chats recevant leur repas en même temps que l’injection d’insuline et ceux recevant leur repas 45 minutes après 13.
Les réévaluations sont essentielles pour la prise en charge à long terme. Chez le chat, une surveillance étroite est particulièrement importante au cours des premiers mois car une rémission du diabète est possible ; si la rémission n’est pas détectée et que l’insulinothérapie est maintenue, une hypoglycémie sévère peut s’ensuivre. La plupart des chats guérissent dans les premiers 3 mois de traitement, mais des rémissions sont possibles après un an voire davantage.
Prise en charge à long terme
Les premières réévaluations sont programmées de manière assez rapprochée (Tableau 1) et consistent à recueillir les observations du propriétaire concernant les signes cliniques, à peser l’animal et à déterminer les taux sanguins de glucose et de fructosamine. Les concentrations de fructosamine augmentent quand le contrôle glycémique se dégrade et elles diminuent quand celui-ci s’améliore. Puisque même les chats diabétiques bien contrôlés restent en hyperglycémie légère à modérée tout au long de la journée, les taux de fructosamine ne se normalisent généralement pas complètement pendant le traitement. A l’inverse, une fructosaminémie normale (en particulier quand les valeurs sont situées dans la moitié inférieure de l’intervalle de référence) doit alerter sur la présence de périodes prolongées d’hypoglycémie, dues par exemple à une rémission du diabète. Les taux de fructosamine situés entre 350 et 450 μmol/L indiquent généralement un bon contrôle, ceux entre 450 et 550 μmol/L un contrôle moyen, et ceux au-dessus de 550-600 μmol/L un mauvais contrôle métabolique.
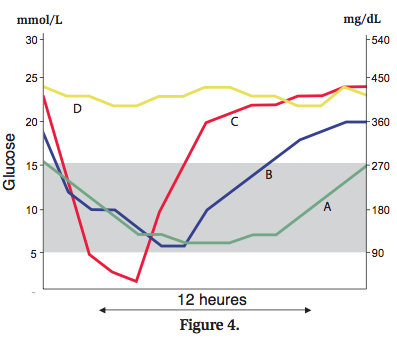
Un dosage unique de la glycémie ne permet généralement pas d’évaluer le contrôle métabolique, et il est recommandé d’établir une courbe de glycémie en mesurant les concentrations de glucose toutes les 2 heures environ sur un total de 12 heures. L’animal reçoit généralement son insuline et son repas à la maison, et la courbe de glycémie est commencée (à domicile ou à la clinique) le plus tôt possible. Les paramètres les plus importants à évaluer sur une courbe de glycémie sont la glycémie minimale et la durée d’action de l’insuline (Figure 4).
- La glycémie minimale doit idéalement se situer entre 5 et 8 mmol/L (90/144 mg/dL). Une valeur inférieure peut être observée en cas de surdosage d’insuline, de chevauchement excessif d’activité des insulines, de consommation alimentaire insuffisante et d’effort intense. Si la glycémie minimale est supérieure à 9 mmol/L, un sous-dosage d’insuline, un stress, un effet rebond de type Somogyi ou des problèmes techniques doivent être envisagés. Si l’animal reçoit déjà des doses élevées d’insuline, une insulinorésistance est également possible. Il est très important d’identifier la cause exacte, car les décisions thérapeutiques vont en dépendre.
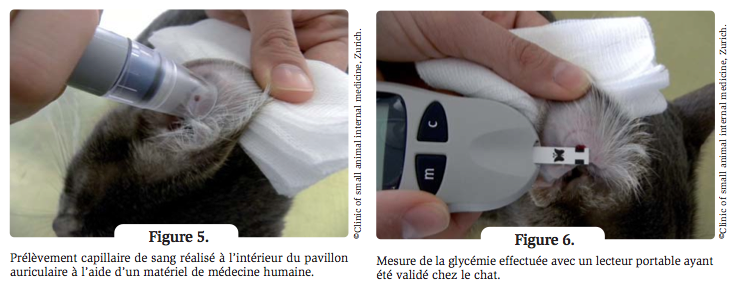
- La durée d’action correspond à la période de temps mesurée entre l’injection d’insuline suivie par une baisse de la glycémie et le moment où la glycémie dépasse 12-15 mmol/L (216-270 mg/dL). Si la durée d’action est inférieure à 8-10 h, les animaux montrent généralement des signes cliniques de diabète, et si la durée d’action est supérieure à 14 h, le risque d’hypoglycémie ou d’effet Somogyi augmente. La durée d’action peut être améliorée par une modification du régime alimentaire, mais si cela ne suffit pas, il est indiqué d’opter pour une insuline de profil d’action différent. ?L’hyperglycémie de stress peut compliquer l’interprétation des courbes de glycémie. Ce problème peut être résolu en réalisant la courbe de glycémie à la maison ; c’est le « suivi à domicile » (Figures 5 et 6).Les propriétaires commencent le suivi à domicile environ 3 semaines après le début du traitement, en déterminant la glycémie à jeun deux fois par semaine (pour se familiariser avec le prélèvement de sang et pour détecter une éventuelle hypoglycémie), et une courbe de glycémie est recommandée au moins une fois par mois.
- Beaucoup de propriétaires peuvent et veulent réaliser un suivi à domicile sur le long terme, et dans une récente enquête, tous les propriétaires ont indiqué que le suivi à domicile leur a permis d’avoir plus confiance dans leur capacité à prendre en charge la maladie de leur animal 14. Notons que les courbes de glycémie réalisées à la maison présentent aussi une certaine variabilité, et donc qu’une courbe unique peut conduire à des conclusions erronées. Dans les cas compliqués, plusieurs courbes peuvent être établies avant de prendre une décision thérapeutique 15, 16.
Difficultés associés à la régulation du diabète
La plupart des chats sont correctement stabilisés dans les trois premiers mois de traitement. Toutefois, il est normal après cette phase d’avoir à ajuster les doses, du fait par exemple d’une perte supplémentaire des cellules bêta ou d’une modification de la sensibilité à l’insuline due à une maladie concomitante. Si les signes cliniques persistent malgré le traitement, il est recommandé d’aborder le problème étape par étape.
- Vérifier que la prise en charge et le traitement actuels respectent bien le protocole. Augmenter la posologie d’insuline tous les 5 à 7 jours jusqu’à ce que le chat reçoive 1-1,5 U/kg 2 fois par jour (insuline lente).
- Vérifier que l’insuline utilisée par le propriétaire n’est pas périmée, n’a pas été secouée, diluée, congelée ou réchauffée, et que les seringues utilisées sont bien adaptées. Vérifier la méthode utilisée par le propriétaire pour mélanger, prélever et injecter l’insuline et faire le point sur le régime alimentaire. Cette étape est fréquemment oubliée, alors que des erreurs techniques sont souvent à l’origine de la mauvaise régulation du diabète.
- Établir une courbe de glycémie pour identifier un éventuel effet Somogyi ou une courte durée d’action de l’insuline. Un suivi à la maison doit être envisagé, car il permet des prélèvements fréquents sans le stress de la clinique.
- Si aucun problème n’est identifié, il faut rechercher la présence d’une maladie induisant une insulinorésistance. En principe, tout type de maladie concomitante (ex. inflammatoire, infectieuse, tumorale) peut entraîner une insulinorésistance. Les principaux problèmes sont la pancréatite, les tumeurs pancréatiques, l’hypercorticisme, l’acromégalie, les infections orales ou urinaires, l’insuffisance rénale chronique et l’obésité.
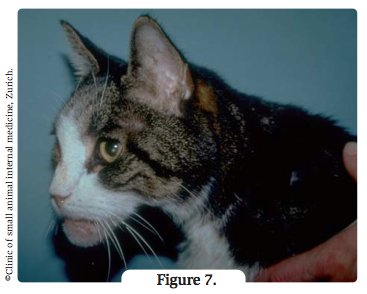
L’hypercorticisme et l’acromégalie (Figure 7) sont ceux qui sont susceptibles de provoquer l’insulinorésistance la plus sévère. Les signes cliniques peuvent être légers à sévères, et l’existence d’une maladie concomitante peut n’être soupçonnée que lorsque le diabète apparaît difficile à réguler.
Conclusion
Le diagnostic précoce du diabète chez le chat permet dans la majorité des cas un traitement satisfaisant. Mais l’évaluation initiale doit viser non seulement à déterminer la sévérité de la maladie (ex. acidocétose) mais également à rechercher une éventuelle maladie concomitante ou des facteurs contributifs (ex. obésité, médicaments diabétogènes). Le traitement doit être mis en place immédiatement après le diagnostic et la plupart des chats peuvent être correctement stabilisés dans les 3 premiers mois de traitement. Rappelons qu’une rémission est observée dans jusqu’à 50 % des cas. Des réévalutations régulières sont essentielles et doivent inclure un examen clinique avec anamnèse et pesée, une courbe de glycémie et une mesure du taux de fructosamine. Si les signes cliniques persistent malgré le traitement, il est recommandé d’adopter une approche systématisée.
Auteur
 Dr. Claudia Reusch, DVM,
Dr. Claudia Reusch, DVM,
Dipl. ECVIM-CA
Clinique de Médecine Interne des Petits Animaux,
Faculté Vetsuisse, Université de Zurich, Suisse
Après avoir obtenu son diplôme à l’Université Justus-Liebig de Giessen en Allemagne, le Dr. Reusch exerce pendant plusieurs années dans des cliniques vétérinaires canines avant de rejoindre l’Université de Munich pour passer une habilitation sur les néphropathies diabétiques du chien et du chat. En 1993, elle devient Professeur de Médecine Interne Petits Animaux à l’Université de Munich. En 1996, elle accepte la Chaire de Médecine Interne Petits animaux et la direction du département à l’Université de Zurich. Diplômée du Collège Européen de Médecine Interne section Animaux de Compagnie en 1997 (ECVIM-CA), elle en prend la présidence de 2003 à 2006. Membre fondateur de la Société Européenne d’Endocrinologie Vétérinaire (ESVE), elle remplit les fonctions de Présidente de 2001 à 2003.
Références
- McCann TM, Simpson KE, Shaw DJ, et al. Feline diabetes mellitus in the UK: the prevalence within an insured cat population and a questionnaire- based putative risk factor analysis. J Feline Med Surg2007; 9: 289-99.
- Lederer R, Rand JS, Jonsson NN, et al. Frequency of feline diabetes mellitus and breed predisposition in domestic cats in Australia. Vet J 2009; 179: 254-8.
- Zini E, Osto M, Franchini M, et al. Hyperglycaemia but not hyperlipidaemia causes beta cell dysfunction and beta cell loss in the domestic cat. Diabetologia 2009; 52: 336-46.
- Reusch C. Feline Diabetes Mellitus. In: Ettinger SJ, Feldman EC, eds. Textbook of Veterinary Internal Medicine. 7th ed, Vol. 2. St. Louis, Missouri: Saunders Elsevier 2010; 1796-1816.
- Reusch CE, Liehs MR, Hoyer M, et al. Fructosamine. A new parameter for diagnosis and metabolic control in diabetic dogs and cats. J Vet Intern Med 1993; 7: 177-82.
- Forman MA, Marks SL, De Cock HE, et al. Evaluation of serum feline pancreatic lipase immunoreactivity and helical computed tomography versus conventional testing for the diagnosis of feline pancreatitis. J Vet Intern Med 2004; 18: 807-15.
- Marshall RD, Rand JS, Morton JM. Treatment of newly diagnosed diabetic cats with glargine insulin improves glycaemic control and results in higher probability of remission than protamine zinc and lente insulins. J Feline Med Surg 2009; 11: 683-91.
- Nelson RW, Henley K, Cole C. Field safety and efficacy of protamine zinc recombinant human insulin for treatment of diabetes mellitus in cats. J Vet Intern Med 2009; 23: 787-93.
- Frank G, Anderson W, Pazak H, et al. Use of a high-protein diet in the management of feline diabetes mellitus. Vet Ther 2001; 2: 238-46.
- Bennett N, Greco DS, Peterson ME, et al. Comparison of a low carbohydrate-low fiber diet and a moderate carbohydrate-high fiber diet in the management of feline diabetes mellitus. J Feline Med Surg2006; 8: 73-84.
- Rucinsky R, Cook A, Haley S, et al. AAHA diabetes management guidelines for dogs and cats.JAAHA 2010; 46: 215-224.
- Slingerland LI, Fazilova VV, Plantinga EA, et al. Indoor confinement and physical inactivity rather than the proportion of dry food are risk factors in the development of feline type 2 diabetes mellitus. Vet J 2009; 179: 247-53.
- Alt M. The effect of feeding time on the quality of metabolic control, day- to-day variability of blood glucose curves and evaluation of IGF-1 levels in cats with diabetes mellitus. Inaugural-Dissertation. Zürich: Klinik für Kleintiermedizin, Vetsuisse-Fakultät Universität Zürich, 2006; 3-43.
- Kley S, Casella M, Reusch CE. Evaluation of long-term home monitoring of blood glucose concentrations in cats with diabetes mellitus: 26 cases (1999-2002). J Am Vet Med Assoc 2004; 225: 261-6.
- Reusch CE, Kley S, Casella M. Home monitoring of the diabetic cat. J Feline Med Surg 2006; 8: 119-27.
- Zini E, Moretti S, Tschuor F, et al. Evaluation of a new portable glucose meter designed for the use in cats. SAT 2009; 151: 448-451.
Site de conseils vétérinaires