La maladie parodontale est la maladie infectieuse la plus répandue chez les animaux de compagnie, avec une prévalence de près de 80 %1 ; cette prévalence augmente avec l’âge et diminue avec la taille de l’animal – elle est beaucoup plus fréquente chez les petits animaux que chez les animaux de tailles moyenne et grande1.
Points clefs
- La maladie parodontale est la maladie infectieuse la plus répandue chez les animaux de compagnie.
- La maladie parodontale pourrait jouer un rôle important dans de nombreuses maladies systémiques : problèmes cardiovasculaires, troubles de la reproduction, maladies hépatiques et diabète.
- Différentes hypothèses ont été proposées pour expliquer comment la parodontite est à même d’interagir avec certaines affections systémiques, mais aucune preuve irréfutable de ce lien n’a pu être avancée pour l’instant.
- Il est possible de prévenir la maladie parodontale par un contrôle soigneux du développement de la plaque bactérienne à l’aide du brossage dentaire et d’une bonne hygiène orale.
Introduction
La maladie parodontale est la maladie infectieuse la plus répandue chez les animaux de compagnie, avec une prévalence de près de 80 %1; cette prévalence augmente avec l’âge et diminue avec la taille de l’animal – elle est beaucoup plus fréquente chez les petits animaux que chez les animaux de tailles moyenne et grande1.
Le parondonte comprend la gencive, le cément, le ligament alvéolo-dentaire et l’os alvéolaire, qui constituent les structures de soutien de la dent. La maladie parodontale est provoquée par la plaque dentaire, et peut se diviser en deux entités : la gingivite et la parodontite.
La gingivite est une inflammation réversible des gencives, car une fois sa cause (plaque bactérienne) éliminée, l’inflammation rétrocède.
La parodontite est, quant à elle, une affection inflammatoire irréversible du tissu non-gingival (ligament alvéolo-dentaire, cément et os alvéolaire) et s’évalue en mesurant la perte d’attache parodontale (déchaussement) de la dent.
La parodontite peut être inactive (quiescente), quand il n’y a pas de signe d’inflammation gingivale (s’il existe une perte d’attachement de la dent, elle doit dater d’avant), ou active, quand une destruction tissulaire est en cours (Figure 1)
Bien que la parodontite soit classée dans les maladies dites « infectieuses », et que plus de 700 espèces bactériennes aient été reconnues capables de coloniser le biofilm du sillon sous-gingival, les postulats de Koch* ne s’appliquent pas2.
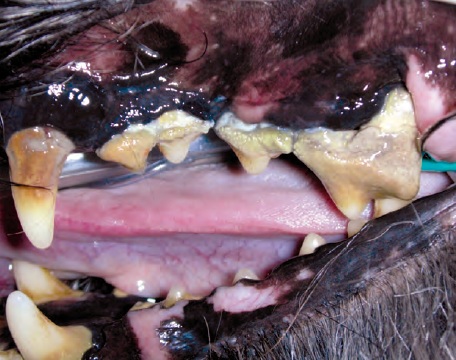
Une gingivite, même non traitée, n’entraîne pas forcément une parodontite ; le développement de la maladie parodontale est en réalité déterminé par un déséquilibre entre la population bactérienne et le système immunitaire de l’hôte. Les capacités immunitaires, le stress, l’âge, les statuts nutritionnel et métabolique, la race et les dysendocrinies sont autant de facteurs susceptibles de favoriser ou de prévenir la progression de la maladie parodontale. Si la maladie progresse, la destruction osseuse et la migration apicale du tissu conjonctif de soutien vont entraîner le déchaussement puis la perte d’une ou plusieurs dents.
La maladie parodontale est une infection focale. Cette notion, introduite il y a plus d’un siècle, décrit une maladie chronique localisée, représentant une source de micro-organismes, toxines et produits de dégradation bactérienne et tissulaire, capables d’atteindre des organes et tissus distants3. La surface de la zone de parodontite a été mesurée chez des races naines et s’est révélée comprise entre 3,18 et 29,8 cm24; la zone de tissu touché peut donc représenter une proportion considérable de la surface totale du corps du chien.
Au cours du développement de la parodontite, les bactéries présentes dans les poches parodontales peuvent atteindre la circulation sanguine, entraînant une bactériémie, et, bien qu’elles soient interceptées par le système réticuloendothélial chez les individus sains5, l’exposition continue prolongée à la bactériémie peut être associée à une maladie systémique touchant des organes et systèmes distants6, 7.
Les conséquences systémiques de la maladie parodontale ne se limitent toutefois pas à la charge bactérienne. Des médiateurs chimiques inflammatoires, des endotoxines bactériennes et des toxines issues de la dégradation tissulaire peuvent également entrer en jeu, soit par le biais d’effets néfastes directs, soit indirectement en provoquant des réactions immunitaires dans des organes distants de la cavité orale.
**Postulats de Koch :
- Le micro-organisme doit être présent en abondance chez un animal souffrant de la maladie, mais doit être absent chez les animaux sains.
- Le micro-organisme doit être isolé chez un animal malade et mis en culture.
- Le micro-organisme cultivé doit déclencher la maladie s’il est inoculé à un animal sain.
- Le micro-organisme doit être isolé chez cet animal infecté expérimentalement et être identique au micro-organisme initial.
Conséquences cardiovasculaires
Plus de 50 études ont été publiées sur le lien entre la maladie parodontale et les maladies cardiovasculaires (MCV) chez l’Homme, et la plupart d’entre elles indiquent une corrélation directe entre les deux. Par exemple, des composants de bactéries parodontopathogènes ont été détectés dans des plaques d’athérosclérose8, et deux méta-analyses récentes ont conclu à l’existence d’une corrélation significative entre la maladie parodontale et les MCV9, 10.
Il en est de même chez l’animal, où des études ont également démontré une corrélation positive entre la présence d’une maladie parodontale et l’observation de modifications histopathologiques dans le cœur et d’autres organes internes4-7. Mais l’opinion scientifique internationale n’est cependant pas unanime quant à l’importance des infections orales dans la genèse des maladies systémiques ; il n’existe en effet aujourd’hui aucune preuve irréfutable d’un lien direct entre la maladie parodontale et d’autres maladies11.
Troubles de la reproduction
Il a été démontré que les femmes enceintes souffrant de parodontite ont jusqu’à 7,5 fois plus de risques d’accoucher prématurément d’un bébé de faible poids. Ce risque est corrélé à l’augmentation de production des cytokines pro-inflammatoires déclenchée par les lipoprotéines bactériennes circulantes. Dans certains cas, des bactéries parodontopathogènes ont été directement détectées dans le liquide amniotique12.
Diabète sucré
Une augmentation des taux de médiateurs chimiques inflammatoires, tels que l’interleukine 6 (IL-6), le TNF (« tumor necrosis factor ») et la protéine C réactive (CRP), pourrait augmenter l’insulinorésistance et donc empêcher le bon contrôle de la glycémie chez les patients diabétiques. Selon un article, le fait d’avoir traité la maladie parodontale d’un chien diabétique avait permis de contrôler sa glycémie par insulinothérapie 13.
Maladie hépatique
Des dégénérescences, stéatoses hépatiques et abcès intra-hépatiques ont été décrits et associés à la parodontite chez l’Homme comme chez le chien 7. Une publication récente a observé que les paramètres de la fonction hépatique s’amélioraient après un traitement parodontal chez l’Homme, et que l’infection bactérienne à Porphyromonas gingivalis pourrait être un facteur de risque de développement/progression de la stéatose hépatique et de la stéatohépatite 14.
Hypothèses étiopathogéniques
Les mécanismes reliant les maladies orales aux maladies systémiques étant particulièrement difficiles à identifier, différentes hypothèses ont été avancées pour expliquer ce lien : l’infection directe, l’inflammation systémique avec lésions endothéliales, et le mimétisme moléculaire entre antigènes bactériens et auto-antigènes.
Hypothèse de l’infection directe
Les bactéries de type Streptococcus spp., Staphylococcus spp., P. gingivalis et leurs produits de dégradation peuvent traverser la barrière vasculaire et entrer dans la circulation générale. Une bactériémie transitoire a été mise en évidence après mastication et brossage de dents ainsi que pendant des prophylaxies et chirurgies dentaires ; mais cette bactériémie n’est généralement pas cliniquement significative chez les sujets sains. Il a cependant été démontré expérimentalement qu’une bactériémie à P. gingivalis entraînait l’apparition d’une athérosclérose chez les porcs et souris sensibles.
Plusieurs agents parodontopathogènes ont ensuite été isolés, soit directement soit indirectement par PCR, dans des organes et tissus distants de la cavité orale. Une étude récente a montré que P. gingivalis était présent dans 100 % des cas de plaques d’athérosclérose chez l’Homme 15, 16.
Hypothèse de l’inflammation systémique
Selon cette hypothèse, la parodontite provoquerait une augmentation des cytokines circulantes pouvant léser directement l’endothélium des vaisseaux sanguins, entraînant la formation de lésions dans le cœur et autres organes internes. Il a été démontré que les cytokines pro-inflammatoires comme le TNF et l’IL-6 peuvent engendrer des mutations myocytaires anaboliques par l’activation de signaux intracellulaires, entraînant une hypertrophie myocardique 17. Plusieurs études ont mis en évidence des taux élevés de CRP dans des cas de parodontite chronique 18, tandis qu’une étude récente 19 a démontré que, chez des patients ayant subi un traitement parodontal intensif (détartrage et surfaçage radiculaire), l’élasticité de l’artère brachiale 24 heures après traitement était significativement inférieure à celle du groupe témoin. Ce phénomène était lié à l’augmentation des taux de CRP et d’IL-6 pendant le traitement parodontal. Toutefois, 60 et 180 jours après le traitement dentaire, l’élasticité vasculaire était significativement augmentée dans le groupe traité par rapport au groupe témoin ; cette augmentation a été attribuée aux effets bénéfiques du traitement parodontal.
Hypothèse de la réactivité croisée
Selon cette hypothèse, le développement de la maladie systémique serait la conséquence d’une réaction immunitaire induite par des protéines de choc thermique (HSP) bactériennes. Toutes les cellules (dont les cellules endothéliales) qui sont soumises à une forme de stress expriment des protéines HSP, et les HSP bactériennes ajoutent une stimulation antigénique supplémentaire lors d’infection. Le système immunitaire n’est pas toujours capable de faire la différence entre HSP bactériennes et HSP autologues de sorte que, pendant une parodontite infectieuse, il y a activation de lymphocytes T et production d’anticorps pouvant provoquer une réaction auto-immune vis-à-vis des tissus de l’hôte qui présentent une similitude antigénique 20. Dans le cas de l’athérosclérose, il a été démontré que les cellules endothéliales expriment une HSP humaine appelée hHSP60 ; il s’est néanmoins avéré que plusieurs espèces bactériennes parodontopathogènes produisent aussi leur propre HSP60, très similaire à la protéine de stress autologue.
Les HSP bactériennes induisent la synthèse d’anticorps spécifiques susceptibles d’attaquer les cellules hôtes. Plusieurs études ont montré que l’infection parodontale pourrait contribuer à l’athérosclérose et aux maladies cardiovasculaires par des mécanismes de réaction croisée 21, 22.
Diagnostic de la maladie parodontale
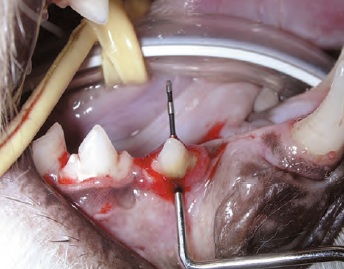
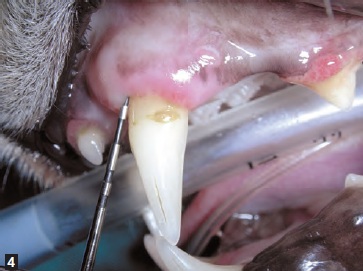
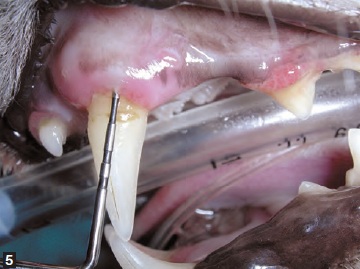
Généralement, la maladie parondontale débute avec peu ou pas de signes cliniques, et le principal motif de consultation pour examen de la cavité orale est l’halitose. Le diagnostic ne peut reposer uniquement sur l’examen visuel de la cavité orale ; il est essentiel de réaliser une anesthésie générale pour effectuer un examen parodontal à l’aide d’une sonde (Figure 2) ainsi qu’une radiographie intra-orale. Il existe différentes sondes parodontales mais toutes sont conçues pour mesurer la profondeur des poches et évaluer une éventuelle hyperplasie ou récession gingivale. La sonde permet aussi d’évaluer le degré de mobilité des dents et la présence de lésions au niveau des bifurcations/ trifurcations radiculaires (Figure 3). La sonde est introduite délicatement dans le sillon gingival (Figures 4 et 5) pour évaluer idéalement 4 à 6 points sur la circonférence de chaque dent ; des dents apparemment saines peuvent avoir des poches profondes sur leurs faces palatines ou linguales. Toutes les observations doivent être consignées dans une fiche dentaire pour permettre une évaluation globale.

Prévention et traitement de la maladie parodontale
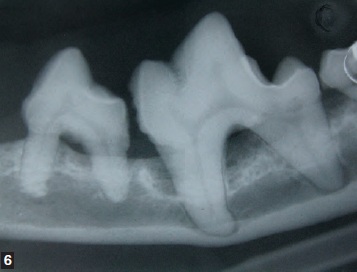
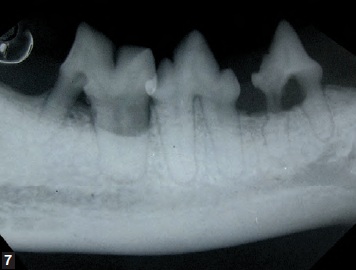
La prévention de la maladie parodontale consiste à éliminer soigneusement la plaque bactérienne par un brossage des dents et une bonne hygiène orale. Certains aliments industriels aident à réduire la plaque dentaire supra-gingivale, mais le point crucial demeure l’élimination de la plaque sous-gingivale. L’objectif n’est pas de stériliser la cavité orale mais d’empêcher le biofilm bactérien de passer d’une population commensale mixte dominée par les bactéries aérobies à une population majoritairement anaérobie. Le traitement de la maladie parodontale doit être réalisé chez l’animal anesthésié et intubé ; après évaluation détaillée des arcades dentaires et analyse des radiographies intra-orales (Figures 6 et 7), un détartrage supra- et sous-gingival est effectué, suivi au besoin d’interventions plus complexes de type extraction dentaire ou chirurgie parodontale.
Antibiotiques
Une maladie parodontale sévère et étendue chez un animal par ailleurs sain ne se traite pas avec des antibiotiques à long terme ; Le bon traitement consiste à éliminer la cause par un détartrage (plaque, tartre) et d’éventuelles extractions nécessaires (parodontite trop avancée). Les antibiotiques doivent être réservés à deux types de situations : le traitement d’une infection locale et la prévention de la bactériémie.
Traitement de l’infection locale
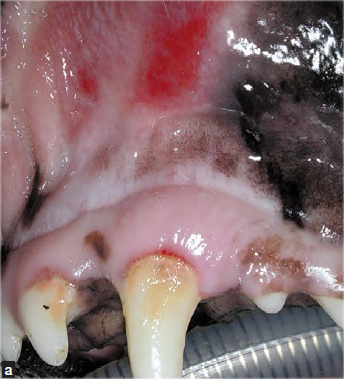
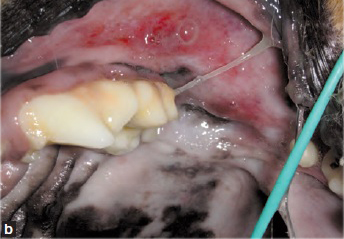
Si la maladie parodontale a entraîné une ostéomyélite du maxillaire ou de la mandibule, une antibiothérapie est recommandée ; elle doit être instaurée quelques jours avant la chirurgie et poursuivie pendant plusieurs semaines. L’administration d’antibiotiques quelques jours avant la chirurgie est également indiquée en cas de lésions gingivales ulcéreuses (même s’il y a peu de plaque), de stomatite paradentaire ulcéreuse chronique chez le chien (Figures 8a et 8b), et de stomatite chez le chat.
Prophylaxie de la bactériémie
La bactériémie est fréquente chez les animaux souffrant de gingivite et de parodontite actives, en raison des activités quotidiennes de léchage et de mastication d’aliments. Chez les animaux sains, elle est rapidement enrayée par l’activité du système réticuloendothélial. Lorsque l’animal a une maladie systémique sévère de type cardiopathie, porte une prothèse articulaire ou oculaire, est splénectomisé ou souffre d’hypercorticisme, et que le métabolisme cellulaire est déprimé par la maladie systémique, le risque d’atteinte de tissus distants justifie l’utilisation d’antibiotiques en péri-opératoire. Dans ces cas-là, l’antibiotique de choix est un bactéricide à large spectre qui peut être administré en intraveineuse à l’induction de l’anesthésie et renouvelé si l’opération dure plus de deux heures. Il est également possible d’administrer une seule dose par voie orale le matin de l’intervention.
Conclusion
Il n’existe aujourd’hui aucune preuve irréfutable de l’existence d’un lien direct entre la maladie parodontale et des effets systémiques, malgré les différentes hypothèses avancées pour expliquer ce lien. Néanmoins, de nombreux éléments suggèrent que la maladie parodontale pourrait favoriser et maintenir l’inflammation dans des organes distants de la cavité orale, et que même lors de parodontite débutante, l’organisme pourrait réagir en synthétisant des protéines de la phase aiguë, démontrant ainsi la stimulation d’une maladie systémique induite par l’inflammation de la cavité orale.
La santé du parodonte n’est pas seulement importante pour la préservation des dents. La maladie parodontale peut avoir un impact significatif sur l’état de santé général et pourrait être responsable de morbidité et de mortalité, en particulier chez certaines races canines sensibles. Des mesures préventives, telles que l’hygiène orale, les jouets à mâcher, les aliments spé- cifiquement conçus pour réduire l’accumulation de la plaque bactérienne et du tartre, doivent être envisagées dans la prise en charge de la parodontite. Les aliments préparés à visée dentaire sont généralement des croquettes dont la forme et la structure procurent une action abrasive mécanique, mais certains produits contiennent également du polyphosphate de sodium, un chélateur du calcium salivaire, qui ralentit la minéralisation de la plaque et donc la formation du tartre. Ces aliments peuvent alors être recommandés en tant qu’adjuvant dans un plan général de réduction de la maladie parodontale.
Bibliographie
- Lund EM, Armstrong PJ, Kirk CA, et al. Health status and population characteristics of dogs and cats examined at private veterinary practices in the United States. J Am Vet Med Assoc 1999;214:1336-1341.
- Haffajee AD, Socransky SS. Introduction to microbial aspects of periodontal biofilm communities, development and treatment. Periodontol 2000,2006; 42:7-12.
- Vieira CL, Caramels B. The history of dentistry and medicine relationship: could the mouth finally return to the body? Oral Dis 2009;15(8):538-46.
- Pavlica Z, Petelin M, Juntes P, et al. Periodontal disease burden and pathological changes in organs of dogs. J Vet Dent 2008;25(2):97-105.
- Silver JG, Martin L, McBride BC. Recovery and clearance of oral micro-organism following experimental bacteremia in dogs. Arch Oral Biol 1975;20:675-9
- Glickman LT, Glickman NW, Moore GE, et al. Evaluation of the risk of endocarditis and other cardiovascular events on the basis of the severity of periodontal disease in dogs. J Am Vet Med Assoc 2009;234:486-494.
- DeBowes LJ, Mosier D, Logan E, et al. Association of periodontal disease and histologic lesions in multiple organs from 45 dogs. J Vet Dent 1996;13:57-60
- Paquette DW. The periodontal infection-systemic disease link: a review of the truth or myth. J Int Acad Periodontol 2002;4(3):101-9.
- Janket SJ, Baird A, Chuang S, et al. Meta-analysis of periodontal disease and risk of coronary heart disease and stroke. Oral Surg Oral Med Oral Pathol 2003;95:559-596.
- Khader YS, Albashaireh ZSM, Alomari MA. Periodontal disease and the risk of coronary heart and cerebrovascular disease: a meta-analysis. J Periodontol 2004;75:1046-1153.
- Glickman LT, Glickman NW, Moore GE, et al. Association between chronic azotemic kidney disease and the severity of periodontal disease in dogs. Prev Vet Med. 2011 May 1;99(2-4):193-200. Epub 2011 Feb 23.
- Peddle GD, Drobatz KJ, Harvey CE, et al. Association of periodontal disease, oral procedures, and other clinical findings with bacterialendocarditis in dogs. J Am Vet Med Assoc. 2009 Jan 1;234(1):100-7.
- Yu G, Yu Y, Li YN, et al. Effect of periodontitis on susceptibility to atrial fibrillation in an animal model. J Electrocardiol. 2010 Jul-Aug;43(4):359-66. Epub 2009 Dec 29.
- O’Reilly PG, Claffey NM. A history of oral sepsis as a cause of disease. Periodontol 2000. 2000;23:13-18.
- Baskaradoss JK, Geevarghese A, Al Dosari AA. Causes of adverse pregnancy outcomes and the role of maternal periodontal status – a review of the literature. Open Dent J 2012;6:79-84. Epub 2012 May 9.
- van Nice E. Management of multiple dental infections in a dog with diabetes mellitus. J Vet Dent 2006;23(1):18-25.
- Yoneda M, Naka S, Nakano K, et al. Involvement of a periodontal pathogen, Porphyromonas gingivalis on the pathogenesis of non-alcoholic fatty liver disease. BMC Gastroenterol 2012;12:16.
- Ford PJ, GemmelE, Hamlet SM et al. Cross-reactivity of GroEL antibodies with human heat shock protein 60 and quantification of pathogens in arterosclerosis. Oral Microbiol Immunol 2005;20:296-302.
- Deshpande RG, KhanMB, Genco CA. Invasion of aortic and heart endothelial cells by Porphiromonas gingivalis. Infect Immun 1998;66:5337-5343.
- Franek E, Blach A, Witula A, et al. Association between chronic periodontal disease and left ventricular hypertrophy in kidney transplant recipients. Transplantation 2005;80:3-5.
- Amar S, Gokce N, Morgan S, et al. Periodontal disease is associated with brachial artery endothelial dysfunction and systemic inflammation. Arterioscler Thromb Vasc Biol 2003;23:1245-1249.
- Tonetti MS, D’Aiuto F, Nibali L, et al. Treatment of periodontitis and endothelial function. N Engl J Med 2007;356:911-920.
- Polla BS. A role for heat shock proteins in inflammation? Immunol Today 1988;9:134-137.
- Wick G, Perschinka H, Xu Q. Autoimmunity and atherosclerosis. Am Heart J 1999;138:444-449.
- Ando T, Kato T, Ishihara K, et al. Heat shock proteins in the human periodontal disease process.Microbiol Immunol 1995;39:321-327.
Auteur et photographies

Dr. Alessandro De Simoi,
Docteur Vétérinaire,
Dipl. EVDC, Italie
Le Dr. De Simoi est diplômé de l’Université de Bologne en 1990 et obtient son diplôme EVDC en 2008. Ses principaux domaines d’intérêt sont la dentisterie et la chirurgie maxillo-faciale des petits animaux et du cheval. Entre 2001 et 2003, il se forme à l’ESAVS (École Européenne des Etudes Vétérinaires Approfondies) au Luxembourg et passe aussi quelque temps au Royaume-Uni (à la Bell Equine Veterinary Clinic et à la Royal Dick School of Veterinary Studies) et aux États-Unis (à l’Université de Pennsylvanie). Il participe à de nombreuses réunions et conférences nationales et internationales sur la dentisterie vétérinaire, et donne des formations sur ce thème en Suisse et en France. De 2001 à 2004, il est secrétaire de la Société Italienne de Dentisterie Vétérinaire et de Chirurgie Orale, dont il est actuellement le Vice-Président.
Article offert par Royal Canin