Le traitement de la maladie parodontale fait en premier lieu appel à un traitement étiologique, mécanique. La question de l’intérêt d’une antibiothérapie mérite néanmoins d’être posée : quand elle est utile, le choix des antibiotiques devra se faire de manière raisonnée, en tenant compte de l’écosystème bactérien de la cavité buccale.
La cavité buccale héberge une flore bactérienne variée et abondante. On considère actuellement qu’il existe chez l’homme plus de 700 espèces bactériennes présentes dans la bouche dont plus de la moitié n’ont pas encore été cultivées et identifiées en laboratoire21, 29.
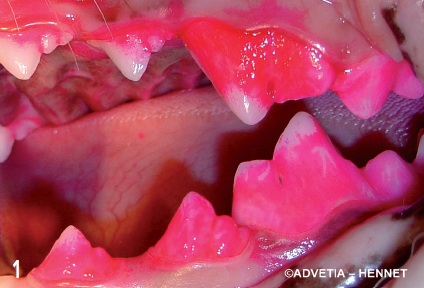
Certaines bactéries s’accumulent progressivement sur les surfaces dentaires pour constituer un biofilm, la plaque dentaire bactérienne10. L’évolution de ce biofilm bactérien avec l’agrégation de bactéries anaérobies aux premières espèces bactériennes colonisatrices détermine l’évolution de la maladie parodontale, de la gingivite à la parodontite (figure 1).
Il n’existe donc pas une espèce bactérienne responsable de la maladie. Celle-ci est due à une rupture de l’écologie buccale par modification de facteurs micro-environnementaux et/ou des défenses de l’hôte favorisant ainsi le développement de germes potentiellement pathogènes mais qui sont faiblement compétitifs à l’état sain (théorie du modèle de la plaque écologique)21.
Flores bactériennes associées aux maladies parodontales
La maladie parodontale associée à la plaque dentaire bactérienne évolue de l’espace supragingival à l’espace sous gingival.
La gingivite n’est qu’une réaction inflammatoire de voisinage sans lésion tissulaire permanente.
La progression sous-gingivale du biofilm bactérien et ses modifications architecturales et bactériologiques permettent la sélection d’espèces anaérobies jusqu’alors minoritaires ; certaines possèdent des facteurs de virulence marqués et sont responsables de la destruction des tissus parodontaux.
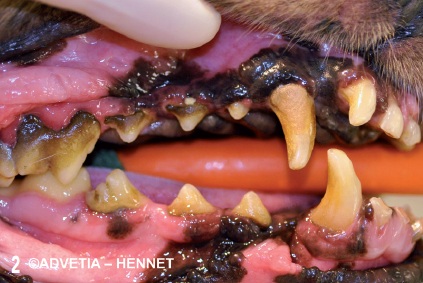
Ainsi, au stade de parodontite, des lésions tissulaires irréversibles s’établissent (destruction osseuse, récession gingivale, migration de l’attache épithéliale avec destruction de l’épithélium de jonction) (figure 2).
Les principales bactéries associées à la parodontite (parodontopathogènes) chez le chien et le chat sont, comme chez l’homme, des espèces anaérobies et en particulier des bacilles à Gram négatif (Porphyromonas sp, Tannerella sp )6, 9, 12, 28.
1 – Principales bactéries sous-gingivales rencontrées chez le chien lors de parodontite
- Actinomyces canis
- Capnocytophaga cynodegmi
- Campylobacter rectus
- Campylobacter showae-like sp.
- Desulfomicrobium orale
- Eikenella modatum
- Eikenella saburreum
- Parvimonas micra (Peptostreptococcus micros)
- Porphyromonas salivosa
- Porphyromonas denticanis
- Porphyromonas gulae (Porphyromonas gingivalis-like)
- Porphyromonas canis
- Porphyromonas denticanium
- Porphyromonas endodontalis
- Porphyromonas cansulci
- Prevotella intermedia
- Pseudomonas brenneri et sp
- Streptococcus constellatus
- Tannerella forsythia
D’après Hardham etal., 2005 ; Rober et al. 2008 ; Riggio et al., 2011.
Rôle de l’antibiothérapie dans le traitement de la maladie parodontale
Le traitement de la maladie parodontale est le traitement parodontal étiologique ou thérapie initiale qui comprend le détartrage supra-gingival, le débridement des poches sous gingivales et le polissage dentaire.
Ce traitement est éventuellement accompagné d’extractions dentaires et doit être suivi d’une hygiène bucco-dentaire rigoureuse (brossage dentaire) et de phases de maintenance (contrôles réguliers)1, 18.
L’utilisation d’un antibiotique seul en l’absence de toute désorganisation mécanique du biofilm bactérien n’a aucune utilité dans le cadre du traitement parodontal19.
Les bactéries incluses dans le biofilm peuvent être 10 à 1000 fois plus résistantes aux antibiotiques qu’elles ne le sont en culture bactérienne8, 10, 20.
Il faut donc absolument proscrire la prescription d’antibiotique en lieu et place d’un traitement dentaire comme cela est encore malheureusement trop souvent le cas lorsqu’un animal est présenté à la consultation pour une halitose, une gingivite, ou une infection dentaire.
À problème dentaire, traitement dentaire. D’ailleurs, ne va-t-on pas soi-même consulter son dentiste, et non pas son médecin, lorsqu’on souffre des dents !
Chez le chien et le chat, l’absence quasi systématique d’hygiène bucco-dentaire doit être prise en compte dans la décision thérapeutique car, chez l’animal comme chez l’homme, le résultat à long terme du traitement de la parodontite en dépend fortement19, 24.
L’antibiothérapie, lorsqu’elle est indiquée lors de parodontite, doit donc être prescrite au moment du traitement parodontal et suivie si possible d’hygiène bucco-dentaire19, 24, 30.
L’antibiotique ne doit pas être utilisé en « couverture » pour espérer rattraper des traitements dentaires insuffisants. Mieux vaut extraire quelques dent de plus, plutôt que de prescrire des antibiotiques pour espérer y pallier, en vain.
Prescription raisonnée d’antibiotique en parodontologie vétérinaire
La vaste majorité des chiens et des chats souffrent de parodontite chronique (localisée ou généralisée), forme de parodontite évoluant progressivement par insuffisance ou absence d’hygiène bucco-dentaire. Le problème pour ces animaux n’est pas le choix du bon antibiotique mais la réalisation de soins bucco-dentaires appropriés.
Il existe cependant certaines formes de parodontite particulièrement destructives, rapides d’évolution ou rebelles aux traitements parodontaux. Elles peuvent s’établir par la présence de conditions favorisantes (dysrégulation immunitaire locale ou systémique, prédisposition génétique, affection débilitante) et/ou par l’invasion tissulaire par certaines bactéries ou par la présence de sites infectieux difficiles d’accès et pour lesquels le traitement parodontal sous gingival est inefficace1, 3.
Il ne faut cependant pas confondre les parodontites récidivantes du fait de l’absence d’hygiène bucco-dentaire ou d’une hygiène imparfaite avec de vraies parodontites réfractaires car c’est bien l’absence d’hygiène qui est responsable de la majorité des échecs en parodontologie vétérinaire.
Certaines études chez l’homme se sont attachées à étudier le rôle potentialisateur (« adjunct therapy ») que pourrait avoir certains antibiotiques sur le traitement de la parodontite chronique en présence d’hygiène bucco-dentaire. Les résultats sont variés et parfois contradictoires et aucune règle en ce sens ne peut être actuellement dictée1, 19, 24.
Les études en ce sens sont quasi inexistantes chez le chien et le chat et sont confrontées à l’absence d’hygiène bucco-dentaire dans le suivi à moyen-long terme31, 32.
En résumé, une antibiothérapie curative semble justifiée chaque fois que le type de maladie (forme agressive, forme réfractaire, forme ulcéreuse ou ulcéro-nécrotique, atteinte loco-régionale ou systémique d’origine dentaire (fièvre, phlegmon, infection odontogène) et/ou le sujet (immunodépression, affection intercurrente et débilitante) sont indicateurs d’une incapacité de l’hôte à gérer normalement l’infection parodontale.
2 – Règles de prescription de l’antibiothérapie en parodontologie – NE PAS FAIRE
- NE PAS prescrire un antibiotique en lieu et place de traitements dentaires appropriés
- NE PAS prescrire régulièrement un antibiotique sous forme de cure pour contrôler l’halitose, « le tartre », une gingivite ou une infection dentaire chronique
- NE PAS prescrire un antibiotique à la place de l’hygiène bucco-dentaire
- NE PAS débuter l’antibiothérapie plusieurs jours ou semaines avant le traitement dentaire.
- NE PAS utiliser un antibiotique peu ou pas actif sur les anaérobies
- NE PAS prescrire des antibiotiques en doses insuffisantes ou pas suffisamment fréquentes.
- NE PAS associer deux antibiotiques sans prendre en compte les risques d’action antagoniste pour le couple bactérie-antibiotiques.
Choix de l’antibiotique
Le choix de l’antibiotique doit tenir compte des germes impliqués dans l’infection et du spectre d’activité de l’antibiotique, de sa biodisponibilité sur le site de l’infection, de l’état immunitaire du patient, de la toxicité et des éventuels effets secondaires de l’antibiotique.
Compte tenu de la difficulté d’effectuer des prélèvements dans de bonnes conditions, de pouvoir bénéficier de conditions de maintien et de transport des germes et enfin de disposer d’un laboratoire possédant la capacité à cultiver et identifier les bactéries anaérobies buccales, les examens bactériologiques et les tests de sensibilité aux antibiotiques ne sont pas utilisés en clinique pour permettre le choix de l’antibiotique.
Ce choix est basé sur la connaissance des germes habituellement impliqués dans la parodontite. L’antibiotique choisi doit posséder une bonne activité sur les bactéries anaérobies (en particulier les bacilles Gram négatifs) et il doit pouvoir être présent si possible dans la poche parodontale avec une concentration proche ou supérieure à la CMI et être administré à la bonne dose et avec le bon rythme d’administration.
Pour certains auteurs, en particulier chez un patient débilité ou immunodéprimé, un antibiotique bactéricide est préférable à un antibiotique bactériostatique1.
Les antibiotiques utilisés en parodontologie humaine et pour lesquels il existe un certain nombre d’études sont indiqués ci-dessous. Parmi, ceux-ci, le métronidazole et sa combinaison à d’autres antibiotiques ont été les plus étudiés depuis près de 30 ans1, 2, 4, 11, 19, 24, 30.
- Amoxicilline (éventuellement associée au Métronidazole)
- Amoxicilline-Acide clavulanique
- Azithromycine
- Clindamycine
- Doxycycline
- Ciprofloxacine (éventuellement associée au Métronidazole)
- Métronidazole (± Spiramycine)
Il existe peu d’études chez le chien et le chat et la majorité se limite à étudier l’effet à court terme de l’antibiotique sur la flore parodontale et/ou certains paramètres cliniques en dehors de tout traitement dentaire15, 16, 17, 26, 34, 36 .
De rares publications ont étudié cliniquement l’effet potentialisateur d’un antibiotique sur le traitement parodontal31, 32. En l’absence de données plus spécifiques, on peut considérer que leur flore parodontale étant proche de celle de l’homme, les mêmes règles s’appliquent et que seules les notions de disponibilité en médecine vétérinaire, de pharmacocinétique et de toxicité potentielle dans les espèces concernées sont à prendre en compte.
Les antibiotiques vétérinaires disponibles en France qui semblent pouvoir remplir les conditions énoncées sont par ordre alphabétique :
- Amoxicilline-acide clavulanique,
- Clindamycine,
- Doxycycline,
- Métronidazole (associé à la spiramycine)
- Pradofloxacine
L’amoxicilline-acide clavulanique est efficace in vitro sur l’ensemble des anaérobies sous gingivaux chez le chien et chez 96 % de tous les isolats14.
Des études ont montré chez le chat que l’amoxicilline-acide clavulanique et la clindamycine sont efficaces à 99 % sur les anaérobies sous gingivaux13.
La doxycycline, la clindamycine et l’association spiramycinemétronidazole ont également été montré efficaces in vitro et in vivo sur Porphyromonas sp26.
La pradofloxacine, nouvelle fluoroquinolone dédiée à la médecine vétérinaire, est un antibiotique bactéricide présentant un spectre large sur les aérobies et les anaérobies. Son activité sur les bacilles anaérobies buccaux (Porphyromonas sp et Prevotella sp) est au moins aussi bonne que celle du métronidazole ou de la clindamycine33, 34, 36.
La céfovécine présente également une bonne activité sur les anaérobies buccaux, cependant pas meilleure que celle de l’amoxicilline-acide clavulanique37.
À noter que pour le métronidazole, la dose recommandée en dentisterie dans les présentations commerciales est différente de celle établie à partir des données pharmacocinétiques (12,5 mg / kg une fois par jour au lieu de 12-22 mg / kg toutes les 12 heures) 7, 17, 25.
3 – Règles de prescription de l’antibiothérapie
Une antibiothérapie curative peut être prescrite en parodontologie dans les cas suivants
- Parodontite ne répondant pas au traitement parodontal hygiénique en présence d’hygiène bucco-dentaire bien effectuée (= forme réfractaire).
- Maladie parodontale associée à une maladie débilitante ou immunosuppressive.
- Gingivite/parodontite ulcéreuse ou ulcéro-nécrotique.
- Parodontite agressive.
- Infection parodontale aiguë associée à des signes loco-régionaux ou généraux (syndrome fébrile, phlegmon, adénomégalie importante).
Le risque de développement de résistance bactérienne lors d’utilisation d’antibiotiques est un sujet de préoccupation et d’actualité. Cette crainte ne doit cependant pas aboutir à un arrêt de l’antibiothérapie mais en une meilleure utilisation. Il semble donc essentiel de ne préconiser l’utilisation d’antibiotiques que si le rapport bénéfice/risque est positif.
Compte tenu du grand nombre de chiens et de chats souffrant de parodontite non traitée et recevant au cours de leur vie de nombreux traitements antibiotiques pour d’autres raisons médicales (infection cutanée, respiratoire, urinaire, digestive…), le risque de développement de résistance bactérienne au sein du biofilm bactérien sous-gingival est élevé.
Il a été démontré que les biofilms persistants jouent un rôle important dans le développement de gènes de résistances24.
L’administration d’antibiotiques lors de soins bucco-dentaires appropriés permettant de disperser mécaniquement le biofilm sous-gingival joue certainement un rôle faible dans le développement de résistance bactérienne au regard du très grand nombre de chien et chat recevant un traitement antibiotique pour un problème bucco-dentaire en dehors de tout soin spécifique ou de ceux souffrant de parodontite non traitée et recevant un traitement antibiotique pour une autre raison.
Si l’on désire limiter le développement d’antibiorésistance, il faut donc commencer par arrêter de prescrire des antibiotiques en lieu et place des traitements dentaires appropriés (extractions, détartrage et débridement sous gingival, hygiène bucco-dentaire) et il faut se préoccuper de soigner correctement la maladie parodontale chez le chien et le chat.
Bibliographie
- American Academy of Periodontology. Position Paper: Systemic Antibiotics in Periodontics. Journal of Periodontology, 2004; 75: 1553-1565.
- AHRQ Publication No. 04-E014-3. Effectiveness of Antimicrobial Adjuncts to Scaling and Root Planing Therapy for Periodontitis. Evidence Report/Technology Assessment Number 88, March 2004.
- Armitage GC. Development of a classification system for periodontal diseases and conditions. Ann Periodontol 1999 ; 4 : 1-6.
- Cionca N, Giannopoulou C, Ugolotti G, Mombelli A. Amoxicillin and metronidazole as an adjunct to full-mouth scaling and root planing of chronic periodontitis. J Periodontol. 2009 Mar;80(3):364-71.
- Dahlén G, Heijl L, Lindhe J, Möller A. Development of plaque and gingivitis following antibiotic therapy in dogs. J Clin Periodontol. 1982 9(3):223-38.
- Dahlén G, Charalampakis G, Abrahamsson I, Bengtsson L, Falsen E. Predominant bacterial species in subgingival plaque in dogs. J Periodontal Res. 2011 Dec 19. doi: 10.1111/j.1600- 0765.2011.01440.x. [Epub ahead of print].
- Dowling PM. Classes of antimicrobial agents (p 290) in Giguère S, Prescott JF , Baggot JD, Walker RD and Dowling PM Antimicrobial therapy in veterinary medicine. 4th Ed. Blackwell Pub, 2006.
- Eick S, Seltmann T, Pfister W. Efficacy of antibiotics to strains of periodontopathogenic bacteria within a single species biofilm – an in vitro study. J Clin Periodontol. 2004;31(5):376-83.
- Elliott DR, Wilson M, Buckley CMF, Spratt DA. Cultivable Oral Microbiota of Domestic Dogs. Journal of Clinical microbiology, Nov. 2005, p. 5470-5476.
- Gilbert P. Biofilms: Their impact on health and their recalcitrance toward biocides. American Journal of Infection Control 2001 ; 29(4):252–255.
- Haffajee AD, , Socransky, S. S. & Gunsolley, J. C. (2003) Systemic anti-infective periodontal therapy. A systematic review. Annals of Periodontology 8, 115–181.
- Hardham J, Dreier K, Wong J, Sfintescu C, Evans RT. Pigmented-anaerobic bacteria associated with canine periodontitis. Vet Microbiol. 2005 Mar 20;106(1-2):119-28.
- Harvey CE, Thornsberry C, Miller BR, Shofer FS. Antimicrobial susceptibility of subgingival bacterial flora in cats with gingivitis. J Vet Dent. 1995 Dec;12(4):157-60.
- Harvey CE, Thornsberry C, Miller BR, Shofer FS. Antimicrobial susceptibility of subgingival bacterial flora in dogs with gingivitis. J Vet Dent. 1995 Dec;12(4):151-5.
- Heijl L, Lindhe J. The effect of metronidazole on the development of plaque and gingivitis in the beagle dog. J Clin Periodontol. 1979 6(4):197-209.
- Heijl L, Lindhe J. Effect of selective antimicrobial therapy on plaque and gingivitis in the dog. J Clin Periodontol. 1980 7(6):463-78.
- Hennet P : Utilisation de la spiramycine et du métronidazole lors de maladie parodontale chez le chien. Rec. Med. Vet., 1991, 167(10/11),1029-1036.
- Hennet P, Girard N. Le « détartrage » doit s’étendre au parodonte. Point Vét, 2005, 258 : 20-24.
- Herrera D, Alonso B, León R, Roldán S, Sanz M. Antimicrobial therapy in periodontitis: the use of systemic antimicrobials against the subgingival biofilm. J Clin Periodontol. 2008 Sep;35(8 Suppl):45-66.
- Hoiby N, Ciofu O, Johansen HK, Song ZJ, Moser C, Jensen PO, Molin S, Givskov M, Tolker-Nielsen T, Bjarnsholt T. The clinical impact of bacterial biofilms. Int J Oral Sci. 2011 Apr;3(2):55-65. Review.
- Kumar PS, Griffen AL, Moeschberger ML, Leys EJ. Identification of candidate periodontal pathogens and beneficial species by quantitative 16S clonal analysis. J Clin Microbiol. 2005 Aug;43(8):3944-55.
- Marsh PD. Are dental diseases examples of ecological catastrophes? Microbiology 2003; 149: 279-94.
- Marsh PD. Dental plaque as a biofilm. Caries Research, 2004, 38 : 204-211.
- Mombelli A, Décaillet F, Almaghlouth A, Wick P, Cionca N. Thérapie parodontale efficace. Schweiz Monatsschr Zahnmed. 2011;121(2):145-57.
- Neff-Davis CA, Davis LE, Gillette EL. Metronidazole: a method for its determination in biological fluids and its disposition kinetics in the dog. J Vet Pharmacol Ther. 1981 4(2):121-7.
- Norris JM, Love DN. Associations amongst three feline Porphyromonas species from the gingival margin of cats during periodontal health and disease. Vet Microbiol 1999 ; 65 : 195-207.
- Riggio MP, Lennon A, Taylor DJ, Bennett D. Molecular identification of bacteria associated with canine periodontal disease. Vet Microbiol. 2011 ; 150 (3-4) : 394-400
- Rober M, Quirynen M, Haffajee AD, Schepers E, Teughels W. Intra-oral microbial profiles of beagle dogs assessed by checkerboard DNA-DNA hybridization using human probes. Vet Microbiol 2008, 127 (1-2) : 79-88/.
- Rylev M, Kilian M. Prevalence and distribution of principal periodontal pathogens worldwide. J Clin Periodontol. 2008 Sep;35(8 Suppl):346-61.
- Sanz M, Teughels W. Group A of European Workshop on Periodontology. Innovations in non-surgical periodontal therapy: Consensus Report of the Sixth European Workshop on Periodontology. J Clin Periodontol. 2008 Sep;35(8 Suppl):3-7.
- Sarkialia E, Asikainen S, Wolf J, Kanervo A, Happonen I, Jousimies-Somer H. Clinical, radiological and bacteriological findings in canine periodontitis. J Small Anim Pract 1993, 34 (6): 265-270.
- Sarkiala EM, Asikainen SE, Kanervo A, Junttila J, Jousimies-Somer HR. The efficacy of tinidazole in naturally occurring periodontitis in dogs : bacteriological and clinical results. Vet Microbiol. 1993 36 (3-4) : 273-88.
- Silley P, Stephan B, Greife HA, Pridmore A. Bactericidal properties of pradofloxacin against veterinary pathogens. Vet Microbiol. 2011 Dec 2. [Epub ahead of print].
- Silley P, Stephan B, Greife HA, Pridmore A. Comparative activity of pradofloxacin against anaerobic bacteria isolated from dogs and cats. J Antimicrob Chemother. 2007 Nov;60(5):999-1003.
- Slots J. Selection of antimicrobial agents in periodontal therapy. Journal of Periodontal Research, 2002; 37; 389–398.
- Stephan B, Greife HA, Pridmore A, Silley P. Activity of pradofloxacin against Porphyromonas and Prevotella spp. Implicated in periodontal disease in dogs : susceptibility test data from a European multicenter study. Antimicrob Agents Chemother. 2008 52 (6) : 2149-55.
- Stegemann MR, Passmore CA, Sherington J, Lindeman CJ, Papp G, Weigel DJ,Skogerboe TL. Antimicrobial activity and spectrum of cefovecin, a new extendedspectrum cephalosporin, against pathogens collected from dogs and cats in Europe and North America. Antimicrob Agents Chemother, 2006, 50 (7) : 2286-92.
Auteur

Dr. Philippe Hennet,
D.V., Dipl. AVDC, Dipl. EVDC, Dentisterie, Chirurgie maxillo-faciale et ORL,
Clinique Vétérinaire ADVETIA,
5, rue Dubrunfaut,
75012 Paris.
Article paru dans le journal “L’essentiel” N°248 du 5 au 11 avril 2012
Site de conseils vétérinaires







