Les premiers travaux réalisés dans les années 1960 ont mis en lumière le lien existant entre la thromboembolie artérielle et les cardiopathies du chat ; l’association de la thromboembolie avec l’endomyocardite et la cardiomyopathie hypertrophique (CMH) observée dans les études nécropsiques et cliniques a été établie dans les années 1970.
Introduction
Les premiers travaux réalisés dans les années 1960 ont mis en lumière le lien existant entre la thromboembolie artérielle et les cardiopathies du chat ; l’association de la thromboembolie avec l’endomyocardite et la cardiomyopathie hypertrophique (CMH) observée dans les études nécropsiques et cliniques a été établie dans les années 1970.
Dès lors, la majorité des publications a traité de la prise en charge de la cardiomyopathie sous-jacente, associée au traitement anticoagulant et/ou fibrinolytique.
Les mécanismes à l’origine de la formation du thrombus ne sont pas encore totalement élucidés ; des recherches récentes tentent d’identifier les causes de la thromboembolie chez les chats sensibles et leurs résultats pourraient permettre d’améliorer l’approche thérapeutique de ce processus pathologique souvent fatal.
Points clefs
- La thromboembolie artérielle est parfois le premier signe de cardiopathie chez le chat.
- La détresse respiratoire observée chez les chats souffrant de thromboembolie artérielle peut être la conséquence de la douleur, de l’insuffisance cardiaque congestive, ou des deux.
- Les signes cliniques sont caractéristiques, et une supplémentation en oxygène, un traitement anti-douleur et du furosémide (en cas d’insuffisance cardiaque) doivent être administrés avant l’évaluation diagnostique.
- La thrombolyse efficace s’accompagne d’un risque de lésions de reperfusion, se traduisant le plus souvent par une hyperkaliémie.
- Des études supplémentaires sont nécessaires pour déterminer les meilleurs protocoles thérapeutiques et établir des méthodes fiables d’identification des chats à risque.
Signes cliniques et diagnostic
La vocalisation aiguë d’origine douloureuse accompagnée de parésie/paralysie d’un ou plusieurs membres est souvent le premier signe de la thromboembolie artérielle. Une tachypnée ou une respiration bouche ouverte peut être observée, due à une agonie ou une insuffisance cardiaque congestive. Les membres touchés sont froids, et les coussinets pâles ou violacés (Figure 1).
Il n’y a généralement pas de pouls artériel, et les muscles des membres touchés peuvent être durs par rapport à ceux des membres indemnes. La mise en évidence de l’occlusion artérielle par absence de signal Doppler ou la visualisation d’un thrombus artériel, à l’échographie, permet de confirmer le diagnostic.
Une lésion médullaire aiguë peut également être à l’origine de ce type de signes cliniques, mais les extrémités des membres touchés sont dans ce cas plutôt chaudes et présentent un pouls artériel.
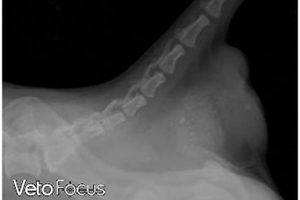
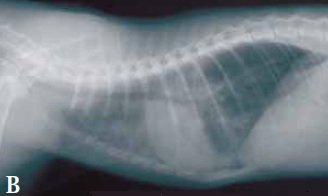
Les radiographies thoraciques peuvent révéler une cardiomégalie et une dilatation bi-atriale ainsi qu’un épanchement pleural ou un œdème pulmonaire (Figures 2a et b). Rarement, une masse pulmonaire est détectée, suggérant une possible origine tumorale ; cela doit être envisagé car un néoplasme peut faire partie des hypothèses diagnostiques chez les chats développant une douleur aiguë des membres avec absence de pouls et coussinets violacés.
Une échocardiographie doit être réalisée une fois le système cardiopulmonaire stabilisé et la douleur traitée ; cet examen peut permettre d’identifier la cardiopathie sous-jacente (hypertrophique, dilatée, restrictive ou cardiomyopathie non classifiée) et peut également mettre en évidence un échocontraste spontané (encore appelé volutes préthrombotiques) ou un thrombus dans l’atrium gauche.
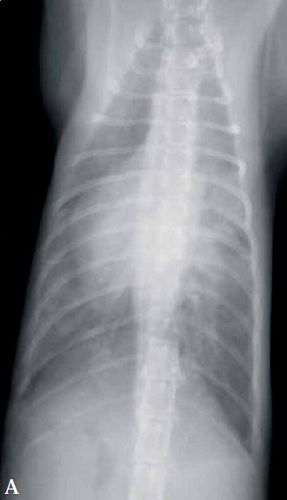
Figures 2A et 2B. Radiographies dorso-ventrale (A) et latérale gauche (B) chez un chat souffrant de thromboembolie artérielle.
Observez la cardiomégalie généralisée ainsi que l’épanchement pleural et les infiltrats alvéolaires, évoquant une insuffisance cardiaque congestive.
Traitement d’urgence
En présence d’éléments engageant le pronostic vital (par exemple, insuffisance cardiaque congestive : crépitements, bruits pulmonaires atténués), la priorité est de stabiliser le système cardiovasculaire. Une oxygénothérapie (en cage, au masque ou par respirateur) et du furosémide (1-2 mg/kg IM toutes les 15 à 30 minutes) doivent être administrés aux chats montrant une détresse respiratoire importante. Une dose totale de furosémide de 5 à 8 mg/kg peut être nécessaire jusqu’à ce que la fréquence respiratoire s’améliore et que le chat urine. Les chats semblent plus sensibles que les chiens aux effets secondaires du furosémide et l’administration d’une nouvelle dose de furosémide ne doit être décidée qu’après évaluation des effets de la dose précédente.
Le contrôle de la douleur est essentiel ; la neuropathie ischémique secondaire à la thrombose artérielle est très douloureuse. Les u-agonistes purs sont souvent le meilleur choix (oxymorphone à 0,05-0,1 mg/kg IM, hydromorphone à 0,05-0,2 mg/kg IM) pour contrôler les douleurs les plus sévères (molécules non disponibles en France NDLR). Après mise en place d’un cathéter veineux, le traitement antidouleur (ainsi que le furosémide) peut être administré toutes les 2 à 4 heures en IV ou en perfusion (fentanyl à 2-5 ug/kg/h IV, par exemple). Des vomissements transitoires peuvent être observés avec les narcotiques. L’acépromazine (0,025 à 0,05 mg/ kg IM ou IV toutes les 4 à 6 h) peut être utilisée pour réduire l’anxiété et elle agit en synergie avec les narcotiques u-agonistes purs. Cette posologie d’acépromazine a peu de risque de favoriser la vasodilatation, mais peut en revanche avoir un effet antiémétique.
La fluidothérapie est à envisager au cas par cas. Les chats en insuffisance cardiaque congestive, ainsi que ceux traités avec du furosémide, ne doivent pas recevoir de solutes IV. Toutefois, certains chats n’ont pas d’insuffisance cardiaque et peuvent être en hypovolémie (bien que cela soit peu probable étant donné le caractère très aigu de la maladie). En général, l’auteur évite la fluidothérapie jusqu’à l’administration des thrombolytiques, où un soluté cristalloïde isotonique (NaCl à 0,9 %) doit alors être administré en IV pour aider à prévenir et à traiter les lésions de reperfusion. L’hyperkaliémie sévère qui peut s’ensuivre (kaliémie > 8 mM/L ou bradycardie) nécessite l’administration de dextrose (0,5 mL de solution IV de dextrose à 50 %) et d’insuline standard (0,5 U/kg IV). Du bicarbonate de sodium (0,5 mM/L) peut également être administré en IV lente sur 20 a 30 minutes. Les anomalies électrocardiographiques observées lors d’hyperkaliémie (Figure 3) peuvent être très discrètes (allongement de l’intervalle PR, par exemple) ou extrêmement sévères (absence d’onde P, ondes T pointues, onde sinusoïdale, par exemple).
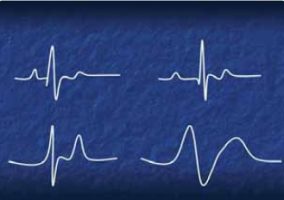
Figure 3. Effets de l’hyperkaliémie sur l’électrocardiogramme. Le trace en haut à gauche montre un rythme sinusal normal.
Au fur et à mesure que la concentration de potassium augmente, l’intervalle PR s’allonge (en haut a droite). Finalement, l’onde P disparaît et l’onde T devient pointue (en bas à gauche). La fusion du complexe QRS et de l’onde T produit une onde sinusoïdale, indiquant une cardiotoxicite extrême de l’hyperkaliémie (en bas a droite).
Thrombolytiques
L’héparine est traditionnellement utilisée à cet effet, bien qu’elle serve en réalité à prévenir l’expansion du caillot, mais pour la thrombolyse proprement dite, deux molécules sont à citer.
Lastreptokinase est souvent évoquée comme traitement de choix
Lastreptokinase a été évaluée de manière rétrospective lors d’une étude 1 s’intéressant aux complications et résultats cliniques ; cette étude avait pour objectifs de déterminer si le temps entre l’apparition des signes cliniques et l’administration de la streptokinase avait une influence sur l’évolution clinique, et d’identifier les facteurs pronostiques favorables ou défavorables.
Les 46 chats inclus dans cette étude ont reçu des doses variables de streptokinase entre 1 et 20 heures suivant l’apparition des signes cliniques ; tous sauf un souffraient de cardiopathie, et 21 d’insuffisance cardiaque. Les perfusions de streptokinase ont duré de 1 à 28 heures mais aucune différence n’a été mise en évidence entre les survivants et les non-survivants en termes de délai, durée ou dose d’administration de la streptokinase.
Les doses les plus élevées n’ont pas été associées à un risque supérieur d’hyperkaliémie ou une tendance aux hémorragies, mais le risque d’hyperkaliémie était corrélé à la durée de la perfusion de streptokinase. Les chances de récupérer un pouls artériel étaient supérieures avec les doses totales élevées, mais ce n’était pas le cas pour la fonction motrice. Des saignements visibles ont été observés chez 11 chats, et 3 ont du être transfusés en raison de la sévérité des hémorragies.
Les chats n’ayant qu’un seul membre atteint avaient plus de chances de survivre une fois rentrés chez eux. La survie après sortie d’hospitalisation (15 chats) variait de 2 jours à 23 mois (moyenne : 51 jours), résultat équivalent à celui d’une autre étude 2 ou la survie moyenne était de 61 jours.
Le délai médian jusqu’à l’évènement thromboembolique suivant était de 100 jours. Selon certains vétérinaires, l’utilisation de la streptokinase dans le traitement de la thromboembolie artérielle féline ne peut être justifiée du fait de son prix, des risques hémorragiques et de la non-amélioration du résultat clinique. Que ce médicament soit ou non bénéfique, la difficulté rencontrée actuellement pour s’en procurer justifie la recherche d’alternatives pour la prévention et le traitement de cette maladie.
L’activateur tissulaire du plasminogène (t-PA) pourrait être une alternative intéressante
Une étude 3 a montré que chez les chats traités avec le t-PA, le délai de reperfusion et de récupération motrice était raccourci ; les animaux remarchaient après 2 jours (contre 2 à 6 semaines lors de guérison spontanée) mais 50 % des cas ont présenté des complications fatales (hyperkaliémie, insuffisance cardiaque congestive et arythmies).
Une autre étude prospective sur l’utilisation du t-PA 4 a montré que 3 des 11 chats traités avaient survécu après l’hospitalisation, mais le fait que tous aient présenté des effets indésirables graves (azotemie, signes neurologiques, arythmies, hyperkaliémie, acidose et mort subite) a poussé les investigateurs à interrompre l’étude.
La posologie actuellement recommandée de t-PA est de 0,25 à 1,0 mg/kg/h en perfusion IV pour une dose totale de 1 à 10 mg/kg 5. Son prix étant élevé, le vétérinaire doit peser le pour et le contre entre l’efficacité, le coût et le taux élevé de complications avant d’opter pour le t-PA.
Exérèse du thrombus
L’exérèse chirurgicale des thrombus artériels a jusqu’à présent donné des résultats mitigés. De nombreuses techniques, allant de l’embolectomie par cathéter à ballonnet à la chirurgie, ont été expérimentées. Toutefois, en raison du risque anesthésique associé à la cardiopathie sous-jacente, la plupart des vétérinaires préconisent actuellement le traitement médical.
Chez les chats ayant déjà souffert de thromboembolie artérielle, la thrombectomie rhéolytique (réalisée à l’aide d’un cathéter permettant de disloquer et d’aspirer le thrombus) peut être une alternative, et peut se révéler efficace et intéressante dans les cas aigus ; mais l’accès à ce type de matériel et son coût sont des facteurs limitants.
Une petite étude 6 a montré une dissolution efficace du caillot chez 5 des 6 chats traités par cette technique. Trois chats ont pu être rendus à leur propriétaire mais tous ont montré des déficits moteurs de degré variable compatibles avec une neuropraxie périphérique distale. Pour 2 d’entre eux, les déficits neurologiques ont disparu dans le mois suivant la sortie d’hospitalisation, et le chat pour lequel le délai entre l’apparition des signes cliniques et la thrombectomie (192 heures) avait été le plus long à montré des déficits qui ont persiste 10 mois après l’intervention avant de disparaitre.
Un des chats survivants est mort brutalement quatre mois après l’intervention et l’autopsie n’a pas permis d’identifier macroscopiquement la cause du décès. Lors d’un contrôle échocardiographique de routine réalisé chez un autre chat survivant, des signes de volutes préthrombotiques ont été observés dans l’atrium gauche 3 mois après l’intervention.
Ce chat est revenu en consultation un mois plus tard avec des signes cliniques similaires à ceux du premier épisode thromboembolique et a été euthanasié.
L’autopsie a confirmé la récidive de thrombose au niveau de la trifurcation aortique. Le dernier chat est mort des suites d’une insuffisance cardiaque congestive associée à une insuffisance rénale chronique deux ans après l’intervention.
Dans cette étude, le délai entre l’apparition des signes cliniques et la thrombectomie ne semblait pas être un important facteur prédictif d’évolution clinique favorable.
Prévention des nouveaux thrombus
La plus grande analyse rétrospective réalisée à ce jour a inclus 127 chats souffrant d’un premier épisode de thromboembolie artérielle 7. Les objectifs de cette étude étaient d’identifier les aspects cliniques à valeur pronostique, d’établir des courbes de survie précises pour les animaux ayant survécu à cet épisode initial, et de comparer les posologies standards et réduites d’aspirine chez ces mêmes animaux. La plupart (76,4 %) des chats de cette étude n’avaient aucun antécédent médical et les mâles étaient surreprésentés (2/1).
Dans la majorité des cas, les deux membres postérieurs étaient touchés par la thromboembolie ; 16 chats n’avaient qu’un seul membre postérieur touché (8 droits et 8 gauches). Un membre antérieur était atteint chez 15 chats et 3 chats avaient à la fois les 2 membres postérieurs et 1 membre antérieur touchés. En outre, un chat souffrait de thrombose mésentérique et un autre de thrombose cérébrale. Des thrombus ont été mis en évidence par échographie dans l’atrium gauche de 6 chats et par autopsie chez 3 chats (2 dans l’atrium gauche et 1 dans le ventricule gauche). Les emboles néoplasiques ne concernaient que 5 % de la population.
Une insuffisance cardiaque était présente chez 55 des 127 chats et 32 chats ont été euthanasiés avant tout traitement. Les traitements administrés variaient selon les préférences des vétérinaires mais incluaient la fluidothérapie, les analgésiques, l’oxygénothérapie et la streptokinase. l’héparine non-fractionnée, à des posologies variables, a été plus utilisée que l’aspirine comme traitement anticoagulant.
Toutes les associations de traitements cités étaient possibles. Le taux de survie global était de 35 % (non différent de celui décrit dans d’autres études 1, 8) et le taux de survie des chats traités était de 45 %, celui-ci tendant à s’améliorer dans les dernières années de l’étude. Cette étude a montré que les chats ayant des températures rectales et des fréquences cardiaques supérieures lors de la consultation initiale avaient plus de chances de survivre.
Parmi les 87 chats ayant survécu au premier événement thromboembolique, 44 ont été traités à domicile avec une dose d’aspirine forte, faible ou nulle, ajoutée aux médicaments cardiaques éventuellement nécessaires.
Onze de ces 44 chats ont déclare 16 nouveaux épisodes thrombo-emboliques, dont 9 ont été fatals. l’intervalle de temps jusqu’à la première récidive était de 191 +/- 152 jours. Neuf de ces 44 chats étaient toujours en vie à la fin de l’étude, avec une survie moyenne de 117 jours. Les chats insuffisants cardiaques au moment du premier épisode ont survécu significativement moins longtemps que les chats non insuffisants cardiaques (77 jours contre 223). Aucune différence significative en termes de survie n’a été observée entre les chats traités avec une forte dose d’aspirine et ceux traités avec une faible dose. Une analyse rétrospective sur 100 cas de thromboembolie aortique féline a montré des résultats similaires à ceux des autres études citées 8.
Les 37 % de chats ayant survécu à l’épisode initial et ayant été rendus à leur propriétaire ont majoritairement été traités avec de la warfarine, décrite comme plus efficace que l’aspirine pour la prévention des récidives de thromboembolie 9. La survie globale moyenne de ces chats était de 11,5 mois. Des informations précises de suivi étaient disponibles pour 22 chats ; 6 d’entre eux ont été euthanasiés pour récidive de thromboembolie.
Notons que la warfarine n’a pas empêché la survenue d’autres épisodes thromboemboliques et qu’elle a en outre entraîné des complications importantes à fatales ; l’utilisation de ce médicament nécessite donc un suivi attentif et une évaluation fréquente des paramètres de la coagulation.
Héparines de bas poids moléculaire
Les héparines de bas poids moléculaire (HBPM) comme la daltéparine et l’énoxaparine sont utilisées depuis peu comme traitements préventifs. Une étude rétrospective sur la daltéparine 10 a eu pour but d’évaluer la facilité et la durée d’administration, les complications et la fréquence des thromboembolies aortiques. Sur les 57 chats inclus, 43 souffraient de cardiomyopathie et ont recu un traitement continu de daltéparine (à la dose de 47 à 220 U/kg toutes les 12 à 24 h SC). Aucun n’a subi de test de coagulation.
Environ 50 % de ces chats avaient déclaré une thromboembolie avant le début du traitement. Huit chats ont été l’objet d’un diagnostic ou d’une suspicion de thromboembolie pendant le traitement. Les animaux ayant presenté un épisode thromboembolique avant l’administration de daltéparine ont montré un risque accru de récidive. Aucune différence en termes de temps de survie n’a été observée par rapport à l’administration concomitante ou non d’aspirine.
Les décès dus à une insuffisance cardiaque congestive ou une euthanasie pour cause d’insuffisance cardiaque ont été supérieurs aux décès par euthanasie pour cause de thromboembolie. Cette étude n’a pas permis de conclure à l’intérêt de la daltéparine dans la réduction des épisodes de thromboembolie cardiaque.
Une étude pharmacocinétique sur les HBPM chez le chat sain a eu pour but de déterminer la dose et la fréquence d’administration nécessaire pour maintenir l’activité anti-Xa entre 0,5 et 1 UI/mL 11, l’efficacité étant mesurée par le degré d’inhibition du facteur Xa. Les résultats ont montré que les HBPM pouvaient être administrées avec efficacité chez le chat sain, mais que des administrations SC fréquentes étaient nécessaires pour contrôler l’activité anti-Xa. Cela pourrait expliquer pourquoi la daltéparine ne s’est pas révélée efficace dans l’étude précédemment citée 10 (administration toutes les 12 à 24 heures).
Quoi de neuf ?
Les recherches s’intéressent depuis peu à l’utilisation des thiénopyridines, des antiagrégants plaquettaires. En théorie, le fait d’empêcher l’activation des plaquettes et la formation de caillots pourrait permettre de prévenir les séquelles thromboemboliques fatales de CMH.
La ticlopidine a été la première étudiée 12 mais a régulièrement entraîné des vomissements et de l’anorexie, d’où un intérêt clinique limité par les effets secondaires malgré une bonne efficacité antiagréante in vitro.
Le clopidogrel, quant à lui, a montré un effet antiagrégant significatif à diverses posologies chez le chat, sans effets indésirables importants 13, et il possède de nombreuses propriétés prometteuses rendant son utilisation clinique séduisante. Une administration orale quotidienne pourrait favoriser l’observance ; les effets antiagrégants ont duré entre 3 et 7 jours après la dernière administration et la sécretion de sérotonine a également été diminuée chez les chats traités (les taux élevés de sérotonine ont été associés à des signes plus sévères de thromboembolie artérielle).
La dose minimale efficace n’a pas été déterminée dans cette étude, mais la plus petite dose utilisée avec une efficacité antiagrégante était égale à 18,75 mg PO toutes les 24 heures, sachant qu’une dose de 75 mg PO toutes les 24 heures s’est également révelée efficace sans entrainer d’effets indésirables.
La prochaine étape consiste à prouver que le clopidogrel est le médicament de choix pour la prévention de la thromboembolie chez le chat souffrant de CMH, à l’aide d’une étude prospective, randomisée en double aveugle contre placebo. Nous espérons que ce médicament se montrera efficace pour prévenir les épisodes de thromboembolie artérielle.
Recherches actuelles sur les troubles de la coagulation
Selon la triade de Virchow, l’hypercoagulabilité serait due à l’interaction de 3 paramètres : une lésion endothéliale, une stase sanguine, et une hyperagrégabilité des plaquettes et/ou des facteurs de coagulation. Les altérations du flux sanguin, notamment la stase sanguine, ont longtemps été accusées d’être à l’origine de la formation des thrombi chez le chat.
Une étude 14 a mis en évidence une baisse de vélocité du flux dans l’auricule gauche des chats et a identifié un sous-groupe à risque accru d’échocontraste spontané et de thromboembolie éventuelle.
Des travaux s’intéressent depuis peu à la mesure des marqueurs hémostatiques chez les chats souffrant de CMH. Deux études récentes 15, 16 semblent montrer que les taux de certaines molécules telles que les complexes thrombine-antithrombine (TAT) et les D-dimères sont augmentés chez les chats gravement malades ou cardiaques, mais la corrélation à la CMH est faible et un individu peut présenter des taux normaux malgré la présence d’une CMH sévère.
Un autre groupe a montré une hypercoagulabilité chez 43 chats souffrant de cardiomyopathie 17 et a mis en évidence ces critères d’hypercoagulabilité chez les chats présentant un échocontraste spontané ou une thromboembolie artérielle, mais pas lors de dilatation atriale gauche seule.
Cette hypercoagulabilité est définie par la présence d’au moins 2 des critères suivants :
- augmentation du fibrinogène
- activité du facteur VIIIc
- faible activité antithrombine
- augmentation des TAT ou des D-dimères
C’est la deuxième étude qui montre que la dilatation atriale gauche en tant que telle n’est pas correlée à l’hypercoagulabilité. Plus recemment, le laboratoire de l’auteur s’est servi d’un analyseur commercialisé 18 pour évaluer la fonction plaquettaire de chats sains et de chats soufrant de CMH, mais a conclu qu’elle ne permettait pas de différencier les animaux sains des animaux malades et que ce n’était pas le meilleur moyen actuel d’explorer l’hypercoagulabilité.
En fait, il n’existe toujours pas d’analyse simple permettant d’évaluer l’état d’hypercoagulabilité chez le chat, mais la thromboelastographie (TEG) est de plus en plus accessible et explore toutes les phases de la coagulation depuis l’initiation de la coagulation jusqu’à la fibrinolyse.
Un groupe a utilisé la TEG pour évaluer l’hypercoagulabilité chez des chats souffrant de CMH 19 et n’a mis en évidence aucune différence significative entre les résultats des chats sains et ceux des chats malades, bien que certains aient pu montrer un état d’hypercoagulabilité.
Conclusion
S’ils sont traités rapidement et efficacement, certains chats peuvent s’améliorer et récupérer la mobilité du membre touché. Le traitement, incluant les médicaments et l’hospitalisation, est coûteux et comporte un risque d’événements indésirables. Mais les améliorations possibles et la survie après hospitalisation font que le chat peut bénéficier d’une bonne qualité de vie jusqu’à la prochaine thromboembolie artérielle.
Références bibliographiques
- Moore KE, Morris N, Dhupa N, et al. rétrospective study of streptokinase administration in 46 cats with arterial thromboembolism. J Vet Emerg Crit Care 2000;10:245-257.
- Atkin CE, Gallo AM, Kurzman ID, et al. Risk factors, clinical signs and survival in cats with a clinical diagnosis of idiopathic hypertrophic cardiomyopathy: 74 cases (1985-1989). J Am Vet Med Assoc 1992;201:613-618.
- Pion PD. féline aortic thromboemboli and the potential utility of thrombolytic therapy with tissue plasminogen activator. Vet Clin North Am Small Anim Pract 1988;18:79-86.
- Welch KM, Rozanski EA, Freeman LM, et al. Prospective évaluation of tissue plasminogen activator in 11 cats with arterial thromboembolism. J Fel Med Surg 2010;12:122-128.
- Pion PD, Kittleson MD. Therapy for féline aortic thromboembolism. In: Kirk RW, editor. Current Vétérinary Therapy. Philadelphia: WB Saunders Co. 1989;295-302.
- Reimer S, Kittleson MD, Kyles AE, et al. Use of rheolytic thrombectomy in the treatment of féline distal aortic thromboembolism. J Vet Intern Med 2006;20:290-296.
- Smith SA, Tobias AH, Jacob KA, et al. Arterial thromboembolism in cats: Acute crisis in 127 cases (1992-2001) and long-term management with lowdose aspirin in 24 cases. J Vet Intern Med 2003;17:73-83.
- Laste N, Harpster NK. A rétrospective study of 100 cases of féline distal aortic thromboembolism: 1977-1993. J Am Anim Hosp Assoc 1995;31:492-500.
- Baty CJ. féline hypertrophic cardiomyopathy: an update. Vet Clin North Am Small Anim Pract 2004;34:1227-1234.
- Smith CE, Rozanski EA, Freeman LJ, et al. Use of low molecular weight heparin in cats: 57 cases (1999-2003). J Am Vet Med Assoc 2004;225:1237-1241.
- Alwood AJ, Downend AB, Brooks MB, et al. Anticoagulant effects of low-molecular weight heparins in healthy cats. J Vet Intern Med 2007; 21:378-387.
- Hogan d’, Andrews DA, Talbott KK, et al. évaluation of antiplatelet effects of ticlopidine in cats. Am J Vet Res 2004;65:327-332.
- Hogan d’, Andrews DA, Green HW, et al. Antiplatelet effects and pharmacodynamics of clopidogrel in cats. J Am Vet Med Assoc 2004;225:1406-1411.
- Schober KE, Maerz I. Assessment of left atrial appendage flow velocity and its relation to spontanéous echocardiographic contrast in 89 cats with myocardial disease. J Vet Intern Med 2006;20:120-130.
- Bedard C, Lanevschi-Piétérsma A, Dunn M. évaluation of coagulation markers in the plasma of healthy cats and cats with asymptomatic hypertrophic cardiomyopathy. Vet Clin Pathol 2007;36:167-172.
- Brazzell JL, Borjesson DL. évaluation of plasma antithrombin activity and D-dimer concentration in populations of healthy cats, clinically ill cats, and cats with cardiomyopathy. Vet Clin Pathol 2007;36:79-84.
- Stokol T, Brooks MB, Rush JE, et al. Hypercoagulability in cats with hypertrophic cardiomyopathy. J Vet Intern Med 2008;22:546-552.
- Jandrey KE, Norris JW, MacDonald KA, et al. Platelet function in clinical healthy cats and cats with hypertrophic cardiomyopathy: analysis using the Platelet Function Analyzer-100. Vet Clin Pathol 2008;37:385- 388.
- Jandrey KE, Norris JW, Kittleson MD, et al. Thromboelastographic (TEG) analysis of cats with hypertrophic cardiomyopathy. In: Proceedings. 8th European Emergency and Critical Care Society Congress, Berlin, 2009;99.
Auteur
 Dr. Karl Jandrey,
Dr. Karl Jandrey,
BS, Dr Vétérinaire, MAS,
Dipl. ACVECC
École de Médecine Vétérinaire,
Université de Californie, Davis, États-Unis
Le Dr Jandrey est diplômé (Dr Vétérinaire et BS) de l’Université d’État de l’Ohio en 1992.
Il travaille ensuite en clientèle en Californie puis effectue un internat et un résidanat avant de démarrer sa carrière enseignante à l’Université de Pennsylvanie.
Il intègre l’UC-Davis en 1999 et y est actuellement Maître-Assistant au Service des Urgences et des Soins Intensifs pour Petits Animaux, exerçant et transmettant son savoir-faire aux étudiants, internes et résidents. Ses recherches s’intéressent aux mécanismes sous-jacents de la thromboembolie chez le chat souffrant de cardiomyopathie hypertrophique.
Published in IVIS with the permission of the editor Close window to return to IVIS Vol 22 No 1 / 2012 / Vétérinary Focus / 31
Article offert par Royal Canin
Site de conseils vétérinaires