L’hypotension est la complication per anesthésique la plus fréquente chez les animaux de compagnie. La mesure de la pression artérielle est recommandée sur tous les animaux anesthésiés. Elle peut se faire par des méthodes invasives et non invasives.
Maîtrise du risque anesthésique
Identifiée précocement, l’hypotension peut très souvent être traitée par des mesures simples et efficaces.
L’anesthésie des animaux de compagnie, même si elle est de mieux en mieux maîtrisée, reste un acte risqué.
Dans une étude portant sur 3 239 animaux anesthésiés, les taux de complications ont été évalués à 12 % chez les chiens et 10,5 % chez les chats1 . L’hypotension représentait 58 % des complications chez le chien et 80 % chez le chat1 .
Ainsi, elle est considérée par certains comme la première complication per anesthésique chez les animaux de compagnie1 .
La mesure de la pression artérielle est recommandée pour tous les animaux anesthésiés2 . Si elle est identifiée précocement, une hypotension peut souvent être traitée par l’application de mesures simples.
Nous exposerons les méthodes permettant d’évaluer la pression artérielle. Puis nous définirons les valeurs acceptables pour un animal anesthésié. Enfin nous proposerons une démarche thérapeutique possible lorsque le praticien se trouve face à une hypotension per anesthésique.
Différentes méthodes de mesure
La pression artérielle correspond à la pression qu’exerce le sang sur la paroi des artères. Elle dépend de la force contraction du myocarde ainsi que de l’élasticité des vaisseaux (équation 1).
Équation 1 : relation entre la pression artérielle, la fonction cardiaque et le tonus vasculaire.
Pression artérielle = Volume d’éjection systolique X résistances vasculaires systémiques
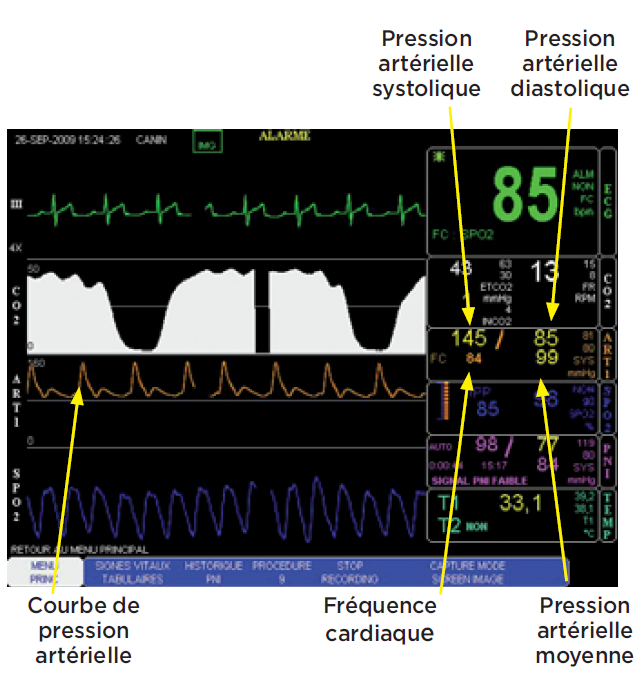
La pression maximale exercée sur les parois des artères est la pression artérielle systolique (PAS). La pression minimale est la pression artérielle diastolique (PAD). La pression artérielle moyenne (PAM) est le résultat d’une équation faisant intervenir la PAS et la PAD (équation 2). Leur unité de mesure est le mm de Hg.
Équation 2 dite de LIAN : relation entre la pression artérielle moyenne et les pressions artérielles systolique et diastolique.
PAM = (PAS + 2PAD) / 3
L’évaluation de la pression artérielle par l’examen clinique est très difficile voir impossible. Le pouls, palpable par exemple sur les artères fémorales, pédieuses ou linguales, est le reflet de la différence entre la PAS et la PAD2 . Par exemple, 2 chiens présentant des valeurs de PAS : 110 mm de Hg, PAD : 70 mm de Hg et de PAS : 70 mm de Hg et PAD : 30 mm de Hg ont le même différentiel entre la PAS et la PAD : 40 mm de Hg. Dans les 2 cas, le pouls palpé est frappé. Le 2e chien est pourtant hypotendu.
Les méthodes utilisées pour évaluer la pression artérielle se classent en 2 catégories : non invasive et invasive.
Les mesures non invasives
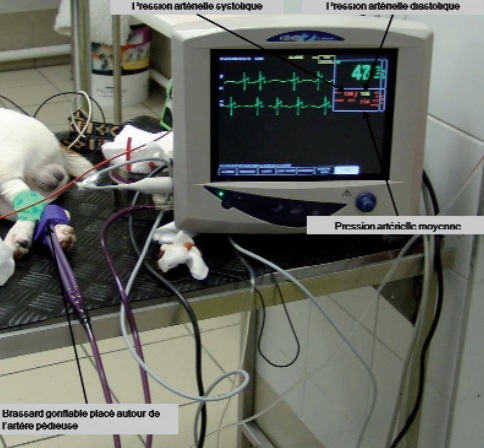
Elles s’effectuent en utilisant un brassard gonflable. La hauteur du brassard doit être comprise entre 40 et 60 % de la circonférence du membre2, 3, 4.
Un brassard trop petit surévalue la valeur de la pression artérielle alors qu’un brassard trop grand la sous-évalue.
- S’il est trop serré, le brassard agit comme un garrot et occlut partiellement l’artère. La mesure est donc sous-évaluée.
- S’il n’est pas assez serré, la pression d’inflation avant la détection d’un signal est trop importante et la mesure est surévaluée5 .
La méthode Doppler
La mesure de la pression artérielle par la méthode Doppler se fait en utilisant un cristal piézzoélectrique.
Il permet de détecter le flux sanguin. Il est placé en regard d’une artère périphérique (artère pédieuse par exemple) distalement au brassard gonflable.
L’artère est occluse par gonflement du brassard. La sonde à ultrasons est maintenue sur l’artère. Le brassard est progressivement dégonflé.
Lorsque le son du flux sanguin est perçu, la valeur lue sur le manomètre est celle de la PAS (photo 1).
Seule la mesure de la PAS est considérée comme fiable.

Cette technique est applicable à tous les animaux, quelle que soit leur taille.
Elle permet d’estimer les valeurs faibles des animaux hypotendus.
Ses inconvénients
- elle mobilise une personne pour chaque mesure.
- Dans des conditions chirurgicales, elle peut être difficile à mettre en place (présence de champs opératoires).
- Elle n’est pas automatisée.
- L’information n’est pas centralisable sur un écran multiparamétrique.
La méthode oscillométrique
Elle repose sur le fait que des oscillations sont perçues dans un brassard placé en surpression sur une artère lorsqu’il est progressivement dégonflé.
La pression pour laquelle l’amplitude des oscillations est maximale correspond à la PAM.
Les oscillations débutent avant la réelle valeur de la pression systolique et se poursuivent au-delà de la réelle valeur de la pression diastolique. Ainsi, des logiciels ont été mis au point afin de déterminer une PAS et une PAD à partir de la mesure d’une PAM (photo 2).
L’algorithme utilisé par les logiciels diffère d’un appareil à l’autre. Il est à l’origine d’imprécisions4 .
Considérant la PAS, il semble que les valeurs au-dessous de 80 mm de Hg sont surestimées et que les valeurs au dessus de 80 mm de Hg sont sous-estimées3, 5, 6, 7. Une équipe a comparé les méthodes oscillométrique et invasive.
L’hypotension a été définie comme une PAM < 60 mm de Hg. Une moyenne de 5 mesures consécutives de la PAM par mesure oscillométrique a été calculée.
Considérant cette moyenne, la sensibilité de la méthode oscillométrique dans la détection de l’hypotension était de 100 % et sa spécificité de 91 %4 .
Lorsque l’on utilise la méthode oscillométrique, il est recommandé de ne prendre en compte que la valeur moyenne d’au moins 5 mesures consécutives3, 5, 6, 8.
La mesure oscillométrique a pour inconvénient
- d’être difficilement applicable aux très petits animaux (< 2,5 kg).
- Elle peut ne pas détecter de signal sur les animaux hypotendus.
Elle a pour avantage
- d’être automatisée
- et les valeurs obtenues peuvent être affichées sur un écran multiparamétrique.
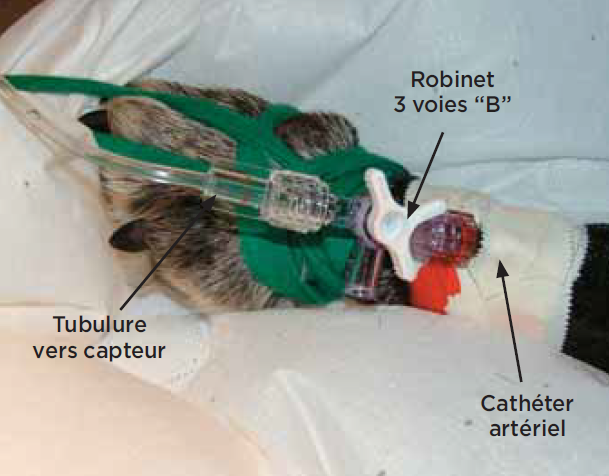
La mesure invasive
C’est la méthode de référence3—8. Elle consiste à placer un cathéter dans une artère périphérique (pédieuse ou auriculaire). Il est ensuite relié par un système de tubulures remplies de sérum physiologique hépariné à un transducteur (photo 3).
La pression exercée à chaque instant par le sang sur la colonne de fluide est captée par le transducteur placé à la même hauteur que l’atrium droit. L’information est alors traitée par un logiciel.
Ses avantages
- Cette méthode est la plus précise.
- Elle permet de suivre l’évolution de la pression artérielle en temps réel (photo 4).
- Elle n’est pas influencée par l’état physiologique du patient (hypo/normo/hypertendu).
- L’information est intégrée à un moniteur multiparamétrique.
Ses inconvénients
- La pose d’un cathéter artériel peut cependant être techniquement difficile et longue.
- Le caractère invasif de la méthode induit des risques d’infection, d’embolie et d’hématome.
- Cette méthode est difficilement utilisable sur les animaux vigiles.
Connaître les variations acceptables
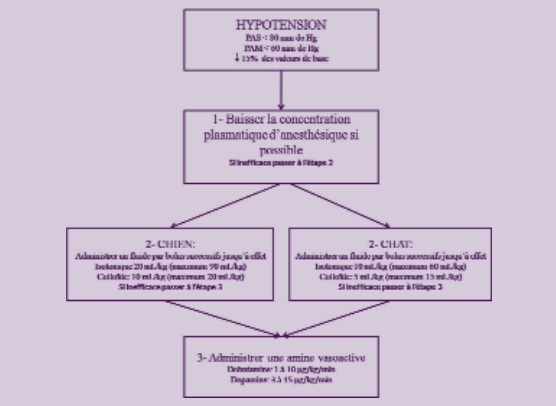
Il est recommandé de ne pas laisser la PAS descendre au dessous de 90 mm de Hg ou la PAM en dessous de 70 mm de Hg.
Une réanimation doit être entreprise lorsque la PAS atteint 80 mm de Hg ou que la PAM atteint 60 mm de Hg.
En dessous de ces valeurs, la perfusion des organes, les reins notamment, n’est plus assurée2 .
L’utilisation de systèmes de mesure automatisés de pression artérielle (oscillométrique, mesure invasive) permet d’obtenir des séries de mesures. Cela offre la possibilité d’établir des courbes de tendances et d’intervenir plus précocement.
Il est actuellement estimé que la pression artérielle ne doit pas varier de plus de 15 % au cours d’une anesthésie.
Ainsi, un animal avec une PAS de 120 mm de Hg en début d’anesthésie doit faire l’objet de mesures spécifiques s’il atteint la valeur de 120 – (0,15 x 120) soit 102 mm de Hg.
Que faire face à une hypotension ?
La grande majorité des agents anesthésiques ont des effets hypotenseurs
- par la diminution
- de la force contractile du cœur
- des résistances vasculaires systémiques
- du tonus sympathique
- par l’augmentation du tonus parasympathique
- l’abolition des mécanismes de réponses physiologiques à une hypotension comme le baroréflexe.
Pour cette raison, il est recommandé que tout animal anesthésié reçoive une perfusion de soluté isotonique à un débit compris entre 10 et 20 ml/kg/h. Si une baisse de 15 % de la pression arté- rielle est observée pendant l’anesthésie, il est recommandé de diminuer la profondeur de l’anesthésie si cela est possible.
L’attention du lecteur doit ici se porter sur 2 points essentiels.
- D’une part, un protocole d’analgésie de bonne qualité est indispensable si l’on veut travailler avec de faibles concentrations d’anesthésiques.
- D’autre part, les animaux de moyen et grand format (>10 kg) recevant un anesthésique volatil (halothane, isoflurane, sévoflurane) sont souvent branchés sur des circuit recirculant qui sont volumineux et peuvent contenir jusqu’à 5 l de mélange.
Ils sont généralement choisis pour travailler à des débits de gaz entrant compris entre 100 et 1000 ml/min. Considérant ces débits, lorsque l’on fait varier la valeur du vaporiseur, il peut s’écouler jusqu’à 30 minutes avant qu’un nouvel équilibre soit atteint. Il est recommandé de fixer le vaporiseur sur la valeur désirée, de débrancher le circuit du patient et d’utiliser la commande de « By Pass » pendant 15 secondes afin de vidanger le circuit rapidement.
Si la baisse d’agent anesthésique n’est pas efficace ou impossible il est recommandé d’avoir recours à une administration de fluides.
L’utilisation d’isotoniques (Ringer Lactate ou NaCl 0,9 %) ou de colloïdes de synthèse (Hydroxy Ethyl Amidon ou HEA) est possible.
L’utilisation d’un soluté glucosé isotonique n’est pas efficace9 . Les doses sont à administrer sous forme de bolus, le plus rapidement possible, jusqu’à obtention de l’effet désiré.
Chez le chien, la dose de soluté isotonique est de 20 ml/kg. Celle d’HEAest de 10 à 15 ml/kg. Les doses maximales à administrer sont de 90 ml/kg d’isotonique et 20 à 30 ml/kg d’HEA. Si ces doses sont atteintes sans que la pression artérielle ne soit rétablie, une autre alternative doit être envisagée.
Chez le chat, la dose de soluté isotonique est de 10 ml/kg. Celle d’HEAest de 5 ml/kg. Les doses maximales à administrer sont de 60 ml/kg d’isotonique et 15 ml/kg d’HEA. Si ces doses sont atteintes sans que la pression artérielle ne soit rétablie, une autre alternative doit être envisagée. Une étude à montré que, sur des chiens anesthésiés avec de l’isoflurane dont l’hypotension est due à une hypovolémie absolue, l’HEA et le Ringer Lactate étaient efficaces pour restaurer la pression artérielle. Néanmoins, l’HEA a permis de restaurer la pression artérielle 3 fois plus rapidement que le Ringer Lactate10 .
Si aucune des mesures précédentes n’est efficace pour maintenir la pression artérielle le recours aux amines vasoactives peut être envisagé. Les 2 principes actifs les plus utilisés sont la dopamine (3 à 15 µg/kg/min) et la dobutamine (1 à 10 µg/kg/min)11, 12.
L’association des 2 molécules peut être envisagée mais, chez le chien dont l’hypotension a été induite avec de l’isoflurane, elle n’a pas fait la preuve de sa supériorité dans le maintient de la PAM lorsqu’elle a été comparée à la dopamine seule (7µg/kg/min)11.
Les principaux effets secondaires se manifestent par l’apparition d’arythmies (extrasystoles ventriculaires, tachycardie ventriculaire, blocs atrio-ventriculaires). Ces troubles du rythme rétrocèdent à l’arrêt du traitement11, 12 .
Il est possible que le rétablissement de la pression artérielle s’accompagne d’un allègement du stade anesthésique du patient et qu’il soit nécessaire d’augmenter le débit de distribution de l’agent anesthésique11 .
En cas de recours aux amines vasoactives, un sevrage progressif (sur plusieurs heures) est recommandé car l’arrêt brutal de l’administration du traitement peut s’accompagner d’une chute de la pression artérielle et d’une hypotension11. Le schéma reprend les étapes de la démarche proposée.
Au total, l’hypotension est la complication per anesthésique la plus fréquente chez les animaux de compagnie. De nombreux appareils sont désormais disponibles en pratique courante et permettent de surveiller la pression artérielle de manière fiable.
- Le taux de complication per anesthésique est d’environ 10 % chez les animaux de compagnie.
- L’hypotension représente 60 % des complications chez le chien et 80 % chez le chat.
- Il est recommandé d’effectuer un suivi de la pression artérielle chez tous les animaux anesthésiés.
- Les 2 méthodes les plus rependues sont la mesure oscillométrique et la mesure invasive.
- Une prise en charge précoce d’une hypotension permet de la traiter dans la pluspart des cas.
La surveillance régulière et l’établissement de tendances évolutives de la pression artérielle permettent au praticien d’intervenir précocement et de réduire les risques de morbidité et de mortalité per anesthésiques.
Bibliographie
- Gaynor JS et coll (1999). Complications and mortality associated with anesthesia in dogs and cats. J Am Anim Hosp Assoc. Jan-Feb;35(1):13-7.
- Haskins SC (2007): Monitoring anesthetized patients. In Lumb and Jones ed. Veterinary anesthesia and analgesia. ed 4. Ames: Blackwell publishing;. p. 533-58.
- Sawyer DC et coll (1991). Comparison of direct and indirect blood pressure measurement in anesthetized dogs. Lab Anim Sci. Apr;41(2):134-8.
- Sawyer DC et coll (2004). Evaluation of a new oscillometric blood pressure monitor in isoflurane-anesthetized dogs. Vet Anaesth Analg. Jan;31(1):27-39.
- Meurs KM et coll (1996). Comparison of the indirect oscillometric and direct arterial methods for blood pressure measurements in anesthetized dogs. J Am Anim Hosp Assoc. Nov-Dec;32(6):471-5.
- Bodey AR et coll (1996). Comparison of direct and indirect (oscillometric) measurements of arterial blood pressure in conscious dogs. Res Vet Sci. Jul;61(1):17-21.
- Hamlin RL et coll (1982). Noninvasive measurement of systemic arterial pressure in dogs by automatic sphygmomanometry. Am J Vet Res. Jul;43(7):1271-3.
- Hunter JS Jr et coll (1990). Adaptation of human oscillometric blood pressure monitors for use in dogs. Am J Vet Res. Sep;51(9):1439-42.
- Kudnig ST, Mama K (2002). Perioperative fluid therapy. J Am Vet Med Assoc. Oct 15;221(8):1112-21.
- Muir WW 3rd, Wiese AJ (2004). Comparison of lactated Ringer’s solution and a physiologically balanced 6% hetastarch plasma expander for the treatment of hypotension induced via blood withdrawal in isoflurane-anesthetized dogs. Am J Vet Res. Sep;65(9):1189-94.
- Rosati M et coll (2007). Response of hypotensive dogs to dopamine hydrochloride and dobutamine hydrochloride during deep isoflurane anesthesia. Am J Vet Res. May;68(5):483-94.
- Dyson DH, Sinclair MD (2006). Impact of dopamine or dobutamine infusions on cardiovascular variables after rapid blood loss and volume replacement during isoflurane-induced anesthesia in dogs. Am J Vet Res. Jul;67(7):1121-30.
EFFIPRO® Spot On : pour 1ml de solution, Fipronil 100 mg, Butylhydroxyanisole (E320) 0,20 mg, Butylhydroxytoluène (E321) 0,10 mg Excipient q.s.p.1ml. Forme pharmaceutique : Solution pour spot on. Solution transparente, incolore à jaune. EFFIPRO® est un Spot-on qui s’applique au contact de la peau entre les omoplates. Indications : Chez les chats : traitement des infestations par les puces (Ctenocephalides spp.) et les tiques (Dermacentor reticulatus). L’efficacité acaricide du produit persiste jusqu’à 2 semaines contre les tiques (Rhipicephalus sanguineus, Ixodes ricinus, Dermacentor reticulatus). Chez les chiens : traitement des infestations par les puces (Ctenocephalides spp.) et les tiques (Dermacentor reticulatus). L’efficacité insecticide contre les nouvelles infestations par des puces adultes persiste jusqu’à 8 semaines. L’efficacité acaricide persiste jusqu’à 4 semaines contre les tiques (Rhipicephalus sanguineus, Ixodes ricinus, Dermacentor reticulatus). Chez les chiens et les chats, si des tiques appartenant à certaines espèces (Rhipicephalus sanguineus et Ixodes ricinus) sont présentes au moment de l’application du produit, elles peuvent ne pas toutes être tuées dans les premières 48 h, mais peuvent l’être au cours de la première semaine. Le produit peut être intégré dans un programme thérapeutique de traitement de la Dermatite par Hypersensibilité aux Piqûres de Puces (DHPP) si celle-ci a été préalablement diagnostiquée par le vétérinaire. Posologie : Usage externe uniquement. Chat : 1 pipette d’EFFIPRO® Spot On pour chats Fipronil 50 mg. Chien de 2 à 10 kg : 1 pipette d’EFFIPRO® Spot On pour petit chien Fipronil 67 mg. Chien de 10 à 20 kg : 1 pipette d’EFFIPRO® Spot On pour chien moyen Fipronil 134 mg. Chien de 20 à 40 kg : 1 pipette d’EFFIPRO® Spot On pour grand chien Fipronil 268 mg. Chien de 40 à 60 kg : 1 pipette d’EFFIPRO® Spot On pour très grand chien Fipronil 402 mg. Voie d’administration :Usage externe uniquement. Appliquer directement sur la peau 1 pipette par animal. Contre-indications : En l’absence de données disponibles, le produit ne doit pas être utilisé sur des chatons de moins de 2 mois et/ou pesant moins de 1 kg. Ne pas utiliser chez le chiot âgé de moins de 2 mois et/ou pesant moins de 2 kg. Ne pas utiliser chez les animaux malades (maladies systémiques, fièvre) ou convalescents. Ne pas utiliser chez les lapins car des effets indésirables parfois létaux peuvent se produire. Ne pas utiliser en cas d’hypersensibilité au principe actif, ou à l’un des excipients. Ne pas utiliser chez le chiot âgé de moins de 2 mois et/ou pesant moins de 2 kg. EFFIPRO® Spot On chien : ce produit a été spécifiquement développé pour le chien, ne pas utiliser chez le chat, pour éviter tout surdosage. Effets indésirables : Si l’animal se lèche, un bref épisode d’hypersalivation peut être observé, principalement lié à la nature du solvant. Parmi les effets indésirables suspectés, des réactions cutanées transitoires au niveau du site d’application (squamosis, alopécie locale, prurit, érythème) et des cas de prurit général ou d’alopécie ont été rapportés après l’utilisation. Ces effets sont extrêmement rares. Des cas d’hypersalivation, des symptômes neurologiques réversibles (hyperesthésie, dépression, symptômes nerveux) ou des vomissements ont été exceptionnellement observés après l’utilisation. Utilisation en cas de gravidité et de lactation : Les études de laboratoire sur le fipronil n’ont pas mis en évidence d’effets tératogènes ou embryotoxiques. Aucune étude n’a été réalisée avec ce produit sur des femelles gestantes et allaitantes. L’utilisation du produit en cas de gravidité ou de lactation ne doit se faire qu’après évaluation du rapport bénéfice/risque établi par le vétérinaire. Temps d’attente Sans objet. Titulaire de l’autorisation de mise sur le marché : VIRBAC 1ERE AVENUE 2065 M L I D 06516 CARROS. Présentations : EFFIPRO® Spot On pour chats Boîte de 4 pipettes de 0,5 ml : 6818486 Boîte de 24 pipettes de 0,5 ml : 6818606 EFFIPRO® Spot On pour petit chien Boîte de 4 pipettes de 0,67 ml : 6975027, Boîte de 24 pipettes de 0,67 ml : 6978132 EFFIPRO® Spot On pour chien moyen Boîte de 4 pipettes de 1,34 ml : 698566 9 Boîte de 24 pipettes de 1,34 ml : 699758 9 EFFIPRO® Spot On pour grand chien Boîte de 4 pipettes de 2,68 ml : 6800434, Boîte de 24 pipettes de 2,68 ml : 6801735 EFFIPRO® Spot On pour très grand chien Boîte de 4 pipettes de 4,02 ml : 6805294, Boîte de 24 pipettes de 4,02 ml 6805578 Date A.M.M 03/03/2009. Usage vétérinaire.
EFFIPRO® Spray : EFFIPRO® 2,5 mg/ml solution pour pulvérisation cutanée pour chat et chien. Fipronil 2,5 mg, Excipient q.s.p.1 ml Forme pharmaceutique : Solution pour pulvérisation cutanée. Solution transparente, incolore à jaune. Indications : Chez les chats et les chiens : traitement des infestations par les puces (Ctenocephalides spp.). Traitement des infestations par les tiques (Ixodes ricinus, Rhipicephalus sanguineus). Traitement des infestations par les poux broyeurs chez le chien (Trichodectes canis) et le chat (Felicola subrostratus). Le produit peut être intégré dans un programme thérapeutique de traitement de la Dermatite par Hypersensibilité aux Piqûres de Puces (DHPP). L’efficacité insecticide contre les nouvelles infestations par des puces adultes persiste jusqu’à 6 semaines chez le chat et jusqu’à 3 mois chez le chien, selon le contexte environnemental. La durée de l’efficacité acaricide du produit est de 4 semaines contre les tiques selon la pression environnementale d’infestation. Voie d’administration : Pistolet pulvérisateur manuel à usage externe uniquement. Le pistolet vaporise 0,5 ml (présentation de 100 ml) ou 1,5 ml (présentation de 250 ml) ou 3 ml (présentation de 500 ml) par pulvérisation. Posologie : Afin d’humidifier le pelage jusqu’à la peau, appliquer 3 à 6 ml par kg de poids corporel (soit 7,5 à 15 mg de fipronil par kg de poids corporel), selon la longueur des poils. Contre-indications Ne pas utiliser chez les animaux malades (maladies systémiques, fièvre) ou convalescents. Ne pas utiliser chez les lapins car des effets indésirables parfois létaux peuvent se produire. Ne pas utiliser en cas d’hypersensibilité au principe actif, ou à l’un des excipients. Effets indésirables : Si l’animal se lèche, un bref épisode d’hypersalivation pourra être observé, principalement lié à la nature du solvant. Parmi les effets indésirables suspectés extrêmement rares, des cas de réaction cutanée transitoire tels qu’érythème, prurit ou alopécie ont été rapportés après l’utilisation. Exceptionnellement, des cas d’hypersalivation, des symptômes neurologiques réversibles (hyperesthésie, dépression, symptômes nerveux), des vomissements ou des signes respiratoires ont été observés après l’utilisation. Utilisation en cas de gravidité et de lactation : Les études de laboratoire sur le fipronil n’ont pas mis en évidence d’effets tératogènes ou embryotoxiques. Aucune étude n’a été réalisée avec ce produit sur des femelles gestantes et allaitantes. L’utilisation du produit en cas de gravidité ou de lactation ne doit se faire qu’après évaluation du rapport bénéfice/risque établi par le vétérinaire. Temps d’attente Sans objet. Titulaire de l’autorisation de mise sur le marché VIRBAC 1ERE AVENUE 2065 M L I D 06516 CARROS. Présentations Boîte de 1 flacon de 100 ml et de 1 pistolet pulvérisateur : 696890 3 Boîte de 1 flacon de 250 ml et de 1 pistolet pulvérisateur : 6972276 Boîte de 1 flacon de 500 ml et de 1 pistolet pulvérisateur : 6974921 Date A.M.M 03/03/2009. Usage vétérinaire.
Auteur
 Dr. Christophe Bille
Dr. Christophe Bille
Centre Hospitalier Vétérinaire des Cordeliers,
29 avenue du Maréchal Joffre,
77100 Meaux.
E-mail : cbille@chvcordeliers.com
www.chvcordeliers.com