Étiologie, signes cliniques et traitements
Le séquestre cornéen félin est une pathologie oculaire fréquente, caractérisée par une pigmentation brunâtre de la cornée avec fréquemment un écoulement de même couleur.1, 2
Cette pigmentation peut être plus ou moins intense et s’accompagner d’un œdème et de vascularisation cornéens. Cette maladie est considérée comme spécifique du chat, mais elle a été décrite chez le cheval et chez un chien.3-5
Le séquestre, généralement unilatéral, peut se développer rapidement ou rester atone. Certaines races de chats semblent prédisposées (Persan, Colorpoint, Himalayen, Birman et Siamois).1, 2, 6-10. Les symptômes apparaissent chez des individus âgés de 2 à 7 ans.1, 2, 8 L’étio-pathogénie, l’aspect clinique et anatomo-pathologique ainsi que les différentes approches thérapeutiques du séquestre cornéen sont revus dans cet article.
Étiologie et pathogénie
La pathogénie de cette maladie de la cornée n’est pas très bien établie. Des pathologies entraînant un traumatisme de la cornée ou une irritation chronique de celle-ci comme la brachycéphalie, les pathologie des annexes de l’œil (entropion, trichiasis), des anomalies du film pré-cornéen, des kératites herpétiques (dues a VHF-1), des dystrophies primaires de la cornée sont suggérées comme des facteurs prédisposant au séquestre.1, 2, 6, 8, 9,11-15 Il peut aussi constituer une maladie primaire du stroma cornéen chez le Persan et l’Himalayen. Il est généralement admis que le séquestre représente une séquelle d’une atteinte du stroma cornéen.1, 2, 8
En effet, la cornée peut se trouver plus exposée chez les races de chat brachycéphales que chez les races de chats normales de par une sensibilité cornéenne très diminuée.16-19 Le contenu lipidique des larmes est significativement plus bas sur les chats ayant une séquestre, suggérant qu’une anomalie du film pré cornéen peut faciliter la formation de séquestres.15 Le rôle du virus VHF-1 n’est pas établi mais il est fortement suggérée par certains auteurs.16 L’apparition de séquestre cornéen suite a l’emploi de corticostéroïdes par voie locale sur des chats infectés expérimentalement avec le virus VHF-1 et des animaux naturellement infectés a été observée.13 La recherche du virus VHF-1 par un test PCR sur des séquestres obtenus lors des kératectomies réalisées chez des Persans et des Himalayens est positive dans 20 à 80% des cas selon les études.16, 17 Bien que les lésions soient fortement colonisées par des bactéries, l’infection bactérienne ne semble pas être impliquée dans la pathogénie de la formation d’un séquestre cornéen mais est secondaire au séquestre.7, 9, 20, 21
On convient généralement que le séquestre est une séquelle non spécifique d’un dommage au stroma cornéen.13 Une étude rapporte qu’un ulcère cornéen chronique (en moyenne 3 mois) était présent dans 55% des cas.2 Il a été aussi démontré que le traitement des ulcères de cornéen atones par une kératotomie linéaire prédisposerait le chat à la formation d’un séquestre.12
L’origine des pigments du séquestre est à l’heure actuelle inconnue. Les sources de ce pigment pourraient être entre autres, le film pré-cornéen,7, 14 le mucus,7, 15 ou les secrétions des glandes de Meibomius.6 Bien qu’il a été établi que ces pigments contenaient une concentration en fer 22 élevée et pas de mélanine,6 une étude récente a identifié des particules de mélanine par micropsie optique et n’a montré aucune différence de concentration en fer entre une cornée saine et une cornée avec séquestre.15
Clinique et anatomo-pathologie
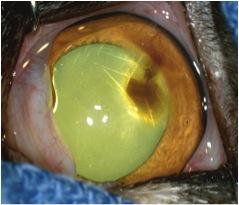
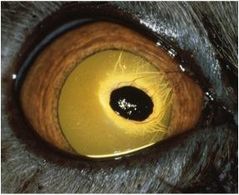
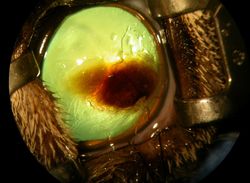
Cette affection de la cornée se caractérise par une zone ambrée (fig. 1)
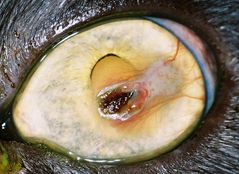
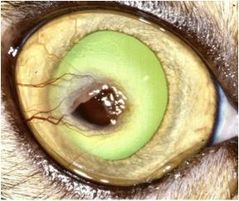
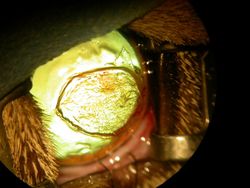
Dans les stades précoces de la maladie à une plaque marron/noirâtre dans les stades avancés (fig. 2, 3, 4, 5a) qui correspond à la région de dégénérescence cornéenne, plus généralement localisée au centre de la cornée.1, 8, 9.

Il s’agit la plupart du temps d’une atteinte unilatérale, mais qui peut être bilatérale (Fig 6).

Ces lésions peuvent varier en étendue et en surface, allant de 1-2 mm de diamètre a une lésion touchant plus de la moitie de la cornée (fig. 2, 3, 4, 5a)




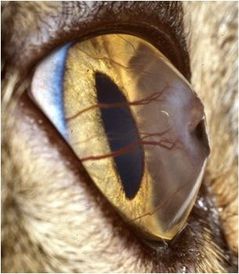
et pouvant atteindre le stroma cornéen antérieur ou plus profond (fig. 5b).
L’épithélium de la cornée est généralement atteint (ulcère épithélial autour de la plage de nécrose)1, 2 (fig. 2, 5a),


une néo-vascularisation (fig. 2, 5a, 5b)



et un œdème de cornée (fig. 2, 5b)1, 23


peuvent être plus ou moins développés et la douleur oculaire engendrée est plus ou moins intense (avec un blépharospasme, un épiphora plus ou moins importants),1, 2, 8, 9, 23 le plus souvent évoluant avec la chronicité. Généralement, la coloration à la fluorescéine se révèle négative sur la plaque de nécrose cornéenne mais positive aux marges de cette plaque. Les signes cliniques sont assez faciles à observer. Il est cependant possible de voir une nécrose de la cornée dans le stroma antérieur de certains chats sans antécédents d’infection virale à VHF-1 et avec un épithélium cornéen intact. 1, 2, 6-8
Les diagnostics différentiels possibles pour une lésion pigmentée de la cornée sont un séquestre cornéen,12, 6-8 un dermoïde cornée,24 une tumeur (mélanome du limbe),25 une kératite pigmentaire,26 une hernie de l’iris 26 et un corps étranger cornéen.26 Les dermoïdes cornéens sont présent a la naissance et généralement en région temporale de la cornée.24 Les mélanomes limbiques ne constituent pas une affection communes du chat et se trouvent principalement en région dorso-temporale du limbe.25 La kératite pigmentaire est une affection rarement rencontrée chez le chat et elle est généralement secondaire a une irritation de la cornée causée par une affection des annexes de l’œil ou une anomalie du film lacrymal et progresse généralement de la périphérie (du limbe) au centre de la cornée.26 Les keratomycoses se caractérisent aussi par une masse brune intrastromale mais restent une affection rare chez le chat.27 Les hernies de l’iris se rencontrent avec une perforation de cornée et une masse de la couleur de l’iris faisant protrusion par la perforation ainsi qu’une déformation de la pupille (dyscorie) sont le plus souvent observables.26 Les corps étrangers sont plutôt bien définis dans leur forme et leur localisation.26
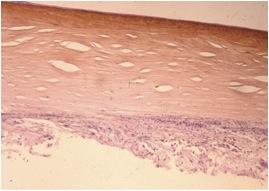
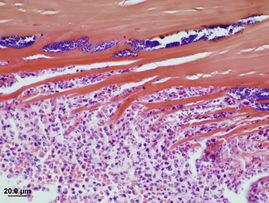
Un séquestre est caractérisé sur le plan anatomo-pathologique par une nécrose du stroma antérieur, une dégénérescence du collagène, des keratocytes nécrosés, un épithélium cornéen absent ou nécrosé et une membrane basale détériorée (fig. 7).6, 9
Une réponse cellulaire inflammatoire (fig. 8) accompagne cette nécrose ce qui laisse suggérer qu’ ‘il s’agit d’une réponse de type corps étranger aux lamelles de collagène stromal nécrosées et desséchées ainsi qu’a la présence fréquente de bactéries opportunistes (fig. 8).6, 9
Une étude récente suggère aussi que l’apoptose des keratocytes jouerait un rôle important dans la pathogénie de cette affection.20
Traitement
Il existe plusieurs approches thérapeutiques du séquestre cornéen, du traitement médical conservateur dans les cas où le séquestre est plus superficiel et la douleur moindre, au traitement chirurgical dans les cas où le séquestre est plus profond et la douleur plus importante.
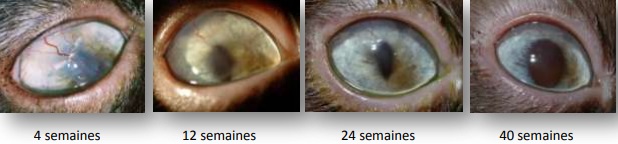
Les traitements médicaux peuvent inclure des larmes artificielles,28 des lentilles de contact thérapeutiques,15 des collyres d’interférons alpah-2b,29 d’antibiotiques, d’anti-viraux.30 Le séquestre peut éventuellement se détacher du stroma sous-jacent de façon naturelle; cela peut prendre des mois à des années. Cette guérison est donc généralement plus lente à obtenir avec un traitement médical qu’avec un traitement chirurgical.1,2,30
Traitement médical: (fig. 9 a, b, c, d)

Les traitements chirurgicaux du séquestre qui ont été décrits sont variés mais les kératectomies lamellaires avec ou sans greffe 31, 32 sont les procédures les plus fréquemment effectuées.1, 30
L’exérèse chirurgicale par une kératectomie lamellaire du séquestre cornéen constitue le premier temps chirurgical des différentes techniques proposées pour traiter un séquestre. Sous anesthésie générale, l’épithélium cornéen non-adhérent est débridé, le séquestre cornéen est retiré, laissant une perte de substance cornéenne plus ou moins large, atteignant une profondeur variable : l’objectif étant de retirer tout tissu cornéen ayant une décoloration brunâtre. (fig. 10 a, b, c, d)
En effet, 38% de rechutes ont été observées lors de kératectomie incomplète, ce qui suggère que la persistance de pigmentation résiduelle peut être un facteur de risque de récidive.1, 30
Traitement chirurgical – La kératectomie lamellaire, un premier temps chirurgical commun à toute technique chirurgicale du traitement du séquestre cornéen (fig. 10 a, b, c, d)


Un risque de récidive de la pigmentation est possible mais semble moindre si une kératectomie est suivie d’une greffe. Un taux de 12% de rechute est observé après une kératectomie complète seule2 alors qu’aucune rechute n’est observée lorsque que la kératectomie a été suivie d’une transposition conjonctivo-cornéenne par exemple.33 Les greffes suivant la kératectomie lamellaire décrites dans ces cas-là sont : des greffes de conjonctive,1, 8, 34 des greffes autologues (dans le cas de la transposition conjonctivo-cornéenne ou TCC) ou hétérologues (kératoplastie lamellaire)33, 35, et des greffes de biomatériaux (sous muqueuse d’intestin ou de vessie de porc, membrane amniotique)1, 36.
La greffe de conjonctive pédiculée est le type de greffe le plus fréquemment réalisé 1, 8, 30, 34. Lors de cette procédure chirurgicale, un pédicule de conjonctive est disséqué le long du limbe et subit une rotation pour couvrir la perte. La greffe de conjonctive facilite la cicatrisation de la cornée en fournissant un support tectonique et un apport vasculaire immédiate et direct à la lésion, ce qui réduit le risque de rechute.1, 2, 30, 34
Ceci est fait aux dépens du champ visuel central et de l’aspect cosmétique (fig. 11 a, b, c).1, 30, 34 Une greffe conjonctivale est cependant recommandée si le séquestre est de taille importante ou/et s’il y a un résidu de tissu nécrosé après la kératectomie.1, 34, 36 Les greffes pédiculées non viables, les greffes pédiculées pigmentées et les greffes pédiculées sectionnées trop tôt ont été associées à des récidives de séquestres.1 Le temps approprié pour la section du pédicule est controversé puisque la section de pédicules 9 mois après la chirurgie a été suivie de rechutes, ce qui suggère de laisser le greffon pédicule intact de façon permanente.1
Traitement chirurgical – Deuxième temps, perte de substance cornéenne comblée par une greffe conjonctivale pédiculée (fig. 11 a, b, c)

Une transposition conjonctivo-cornéenne (TCC) peut aussi être réalisée pour couvrir la perte de substance laissée par la kératectomie. Lors de cette procédure chirurgicale, un volet de cornée, de limbe et de conjonctive de la région dorsale à la perte de substance est disséqué et transposé ventralement pour couvrir la perte. Cette technique est préconisée pour des pertes de substances cornéennes des petites et centrales car les résultats obtenus sont plus cosmétiques et fonctionnels (visuel).30, 33 Une meilleure transparence cornéenne est obtenue avec une TCC car la cicatrice cornéenne est bien moins importante que lors d’une greffe de conjonctive (fig. 12 a, b, c, d). Une étude menée sur 15 chats opérés par cette technique montre la meilleure clarté de la cornée.2 Aucune récidive n’est observée sur des chats ayant subi une TCC durant toute la durée du suivi postopératoire qui s’est étendu de 30 jours a 7 ans.2,30,33
Traitement chirurgical – deuxième temps, perte de substance cornéenne comblée par une transposition conjonctivo-cornéenne (fig. 12 a,b,c,d)
L’usage de biomatériaux et notamment de la sous-muqueuse d’intestin de porc (Biosist) suivant la kératectomie (fig. 13 a, b) a été décrit et les résultats cosmétiques se sont révélés bons.36 D’autres types de biomatériaux pourraient aussi être envisagés comme le péricarde, la membrane amniotique qui ont déjà été utilisés en chirurgie cornéenne. 36, 37
Traitement chirurgical – deuxième étape, perte de substance cornéenne comblée par une greffe de Biosist (sous muqueuse d’intestin de porc) (fig. 13 a, b)


Le traitement post-chirurgical consiste en l’administration d’anti-inflammatoires non-stéroïdiens (meloxicam 4 mg/kg, per os une fois par jour pendant 7 jours) pour contrôler la douleur et l’inflammation, d’une association d’antibiotiques (a appliquer 3 fois par jour, sur l’œil droit pendant un mois) pour éviter les infections et le maintien d’un carcan pour éviter l’automutilation (24 heures sur 24 pendant 3 semaines). L’application d’une pommade hyperosmotique (chlorure de sodium 0.9%, 2 fois par jour, sur l’œil droit pendant 3 semaines) pour limiter l’œdème de cornée peut aussi être envisagée. 30
Le séquestre cornéen félin représente une affection cornéenne fréquente chez le chat, plus souvent observée chez les chats brachycéphales, notamment chez les Persans, Birmans et Himalayens ; Il s’agit d’une nécrose de la cornée qui se caractérise par une pigmentation brunâtre de celle-ci. Le séquestre peut se développer rapidement ou rester statique et le choix thérapeutique va dépendre de cette évolution. Le traitement médical n’est envisageable que si le séquestre est superficiel et la douleur moindre. Le traitement chirurgical, quelque qu’il soit, est recommandé dans les cas de chronicité du problème oculaire, de douleur importante présente et de profondeur déjà significative de la lésion au sein du stroma cornéen. Le traitement chirurgical consiste généralement en une exérèse de la région nécrosée de la cornéen par kératectomie lamellaire suivie d’un recouvrement du site d’exérèse par une greffe (de tissus variés) ce qui réduire considérablement la rechute.
Remerciements
L’auteur tient à remercier le Dr. Pascal Prélaud pour son aide à la préparation de ce manuscrit.
Références
- Featherstone HJ, Sansom J. Feline corneal sequestrum: a review of 64 cases (80 eyes) from 1993-2000. Vet Ophthalmol 2004;7:213-227.
- Morgan RV. Feline corneal sequestration: A retrospective study of 42 cases (1987-1991). J Am Anim Hosp Assoc 1994;30:24-28.
- Hakanson NE, Dubielzig RR. Chronic superficial corneal erosions with anterior stromal sequestration in three horses. Vet Comp Ophthalmol 1994;4:179-183.
- McClellan GJ, Archer FJ. Corneal stromal sequestration and keratoconjunctivitis sicca in a horse. Vet Ophthalmol 2000;3:207-212.
- Bouhanna L, Liscoët LB, Raymond-Letron I.Corneal stromal sequestration in a dog. Vet Ophthalmol. 2008;11(4):211-4.
- Pentlarge VW. Corneal sequestration in cats. Compend Cont Ed Pract Vet 1989;11:24-32.
- Souri EN. The isolated black lesion of the feline cornea. Vet Med Small Anim Clin 1972:67;155-158.
- Startup FG. Corneal necrosis and sequestration in the cat. A review and record of 100 cases. J Small Anim Pract 1988;29:476-486.
- Gelatt KN, Peiffer RL, Stevens J. Chronic ulcerative keratitis and sequestrum in the domestic cat, J Am Anim Hosp Assoc 1973;9:204-213.
- Vawer GD. Corneal mummification in colour point cats. Vet Rec 1981;109:413.
- Grahn BH, Sisler S, Storey E. Qualitative tear film and conjunctival goblet cell assessment of cats with corneal sequestra. Vet Ophthalmol 2005;8:167-170.
- La Croix N, van der Woerdt A, Olivero DK. Nonhealing corneal ulcers in cats: 29 cases (1991-1999), J Am Vet Med Assoc 2001;218:733-735.
- Nasisse MP, Guy J, Davidson M, et al. Experimental ocular herpes virus infection in the cat, Invest Ophthalmol Vis Sci 1989;30:1758-1768.
- Davidson HG, Gerlach JA, Bull RW. Determination of protein concentration and their molecular weight in tears from cats with normal corneas and cats with corneal sequestrum. Am J Vet Res 1992;53:1756-1759.
- Featherstone HJ, Franklin VJ, Sansom J. Feline corneal sequestrum: laboratory analysis of ocular samples from 12 cats. Vet Ophthalmol 2004;7:229-238.
- Nasisse MP, Glover TL, Moore CP, et al. Detection of feline herpesvirus 1 DNA in corneas of cats with eosinophilic keratitis or corneal sequestration. Am J Vet Res 1998;59:856-858.
- Stiles J, McDermott M, Bigsby D, et al. Use of nested polymerase chain reaction to identify feline herpesvirus in ocular tissue from clinically normal cats and cats with corneal sequestra or conjunctivitis. Am J Vet Res 1997;58:338-342.
- Volopich S, Benetka V, Schwendenwein I, et al. Cytologic findings, and feline herpesvirus DNA and Chlamydophila felis antigen detection rates in normal cats and cats with conjunctival and corneal lesions. Vet Ophthalmol 2005;8:25-32.
- Blocker T, van der Woerdt A. A comparison of corneal sensitivity between brachycephalic and domestic short-haired cats. Vet Ophthalmol 2001;4:127-130.
- Cullen CL, Wadowska DW, Singh A, et al. Ultrastructural findings in feline corneal sequestra. Vet Ophthalmol 2005;8:295-303.
- Formston C, Bedford PGC, Staton JF, et al. Corneal necrosis in the cat. J Small Anim Pract 1974;15:19-25.
- Ejima H, Hara N, Kaligaya H. Detection of iron in a blackish lesion in a case of feline corneal sequestrum. J Vet Med Sci 1993;55:1051-1052.
- Dice PF. Primary corneal disease in a dog and cat. Vet Clin North Am Small Anim Pract 1980;10:339-356.
- Hendy-Ibbs PM. Familial feline epibulbar dermoids. Vet Rec 1985;116:13-14.
- Harling DE, Peiffer RL, Cook CS, et al. Feline limbal melanomas: four cases. J Am Anim Hosp Assoc 1986;22:795-802.
- Moore PA. Feline Corneal Disease. Clin Tech Small Anim Pract 2005;20:83-93.
- Miller DM, Blue JL, Winston SM. Keratomycosis caused by Cladosporium sp in a cat. J Am Vet Med Assoc 1983;182:1121-1122.
- Cullen CL, Njaa BL, Grahn BH. Ulcerative keratitis associated with qualitative tear film abnormalities in cats. Vet Ophthalmol 1999;2:197-204.
- Leber A. The use of topical interferon a-2b in feline corneal disease. A preliminary report in Proceedings. 15th Annual Meet ECVO/ESVO 2000;32.
- Glaze MB, Gelatt KN. Feline Ophthalmology. In: Gelatt, KN, ed. Veterinary Ophthalmology, 3rd ed. Baltimore: Lippincott, Williams, and Wilkins,1999;997-1052.
- Peiffer RL, Gelatt KN. Superficial keratectomy for the treatment of chronic ulcerative keratitis and sequestrum in the domestic cat. Feline Pract 1976;6:37-40.
- Whitley RD. Management of feline corneal sequestration-surgical therapy. Vet Med Report 1989;1:259-261.
- Andrew SE, Tou S, Brooks DE. Corneoconjunctival transposition for the treatment of feline corneal sequestra: a retrospective study of 17 cases (1990-1998). Vet Ophthalmol 2001;4:107-111.
- Blogg JR, Stanley RG, Dutton AG. Use of conjunctival pedicle grafts in the management of feline keratitis nigrum. J Small Anim Pract 1989;30:678-684.
- Gimenez MT, Farina IM. Lamellar keratoplasty for the treatment of feline corneal sequestrum. Vet Ophthalmol 1998;1:163-166.
- Featherstone HJ, Sansom J, Heinrich CL. The use of porcine small intestinal submucosa in ten cases of feline corneal disease. Vet Ophthalmol 2001;4:147-153.
- Ollivier FJ, Kallberg ME, Plummer CE, Barrie KP, O’Reilly S, Taylor DP, Gelatt KN, Brooks DE. Amniotic membrane transplantation for corneal surface reconstruction after excision of corneolimbal squamous cell carcinomas in nine horses. Vet Ophthalmol. 2006;9(6):404-13.
Auteur
Dr. Franck Ollivier, DMV, Diplomé ACVO et ECVO
Animal Eye Doctor, www.animaleyedoctor.fr
Centre vétérinaire DMV, 2300 54ème avenue,
Montréal, Canada
www.centreDMV.com