Il existe chez le chat des manifestations inflammatoires (ulcératives, ulcéroprolifératives) de la muqueuse buccale, particulièrement en région caudale, évoluant vers la chronicité et rebelles aux traitements.
Ces phénomènes dépassent largement le cadre du parodonte et ont été désignés par différents termes : gingivo- stomatite chronique, stomatite chronique, stomatite lympho-plasmocytaire ou stomatite granulomateuse5, 12, 25.
Il s’agit en fait beaucoup plus d’un mode de réaction de la cavité buccale que d’une maladie spécifique7, 9. Il existe très peu d’études épidémiologiques sur cette entité clinique et leurs résultats varient avec la définition des lésions.
Dans une étude concernant 753 chats présentés dans des cliniques vétérinaires belges, Verhaert et al.24 identifièrent 12 % de chats présentant une affection allant bien au-delà de la parodontite et pouvant être considérée comme une gingivo-stomatite chronique.
Dans une étude plus large portant sur 4 858 chats, Healey et al.6 en utilisant une définition différente de cette entité clinique, trouvèrent une prévalence de 0,7 %.
Le terme de « stomatite » désigne une inflammation de la cavité buccale au sens large. Les stomatites peuvent avoir une origine infectieuse, organique ou métabolique mais, quel qu’en soit la cause, les surinfections bactériennes contribuent largement aux lésions. Le terme de « stomatite » étant souvent utilisé pour désigner toutes sortes de lésions rouges de la cavité buccale, il faut, pour une meilleure compréhension, séparer les différentes entités cliniques.
Approche lésionnelle
L’atteinte inflammatoire des gencives et des tissus sous-jacents induite par la flore parodontale – gingivite et parodontite – se caractérise par des lésions localisées aux arcades dentaires et à leur pourtour immédiat.
Certaines formes de parodontite (parodontite agressive, parodontite ulcéro-nécrotique, parodontite associée à des désordres systémiques) peuvent être accompagnées de destructions tissulaires importantes et prendre ainsi un aspect spectaculaire.
À l’opposé, certaines lésions de localisation éloignée de l’arcade dentaire n’ont pas de relation directe avec la maladie parodontale. Elles peuvent parfois être indirectement liées à la flore parodontale (lésion ulcérative de la muqueuse en regard des couronnes dentaires – lésion en décalque ou « kissing lesions ») ou n’avoir aucune relation avec celle-ci (lésion du palais, de la langue, du pharynx, etc).
Il est important de pouvoir différencier les lésions par leur localisation et leur aspect.
On peut ainsi reconnaître chez le chat certaines entités cliniques particulièrement spectaculaires :
- Gingivite ulcéro-proliférative chez de jeunes chats (ou « gingivite hyperplasique juvénile ») (figure 1);
- parodontites agressive et ulcéro-nécrotique (figure 2);
- buccostomatite ulcérative ou ulcéro-proliférative (inflammation de la muqueuse buccale en regard des dents) (figures 3 et 4);
- stomatite caudale ulcérative ou ulcéroproliférative (inflammation de la muqueuse latérale aux plis palatoglosses – également qualifiée de « palatoglossite ») (figure 5).
La présence d’une « stomatite caudale » est la lésion qui conduit le plus souvent à la dénomination de stomatite chronique féline. Les anglo-saxons ont classiquement décrit cette lésion sous le terme de « faucitis ».
C’est un terme erroné puisque les « fossae » auxquels il se rapporte sont les parois latérales du pharynx et donc situées plus caudalement. L’utilisation du terme de palatoglossite n’est pas également totalement adaptée puisque la muqueuse atteinte est située latéralement au pli palatoglosse9, 19.
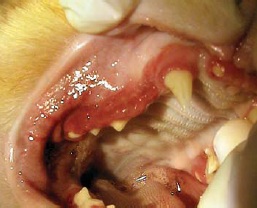
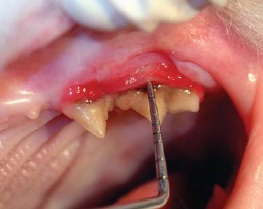
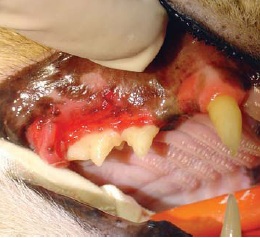
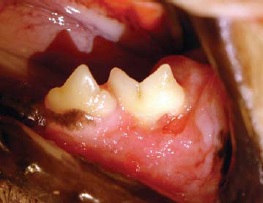
Récemment, le terme de « caudal stomatitis » a été proposé et c’est celui que nous retenons14.
Nous comprenons donc dans la désignation « stomatite chronique féline » ou « gingivo-stomatite chronique féline » une entité clinique dans laquelle une stomatite caudale est présente.
Approche étiologique
Les lésions rouges de la cavité buccale correspondent plus souvent à un mode réactionnel qu’à une maladie précise. Si la maladie parodontale est presque toujours présente et vient s’ajouter aux autres lésions buccales, elle ne suffit parfois pas, à elle seule, à expliquer l’ampleur du problème. Dans un milieu buccal naturellement contaminé, l’écologie ne peut être maintenue que par un système de défense efficace.
Toute rupture de cet équilibre permet l’aggravation de la maladie parodontale et éventuellement l’apparition d’autres lésions : parodontite agressive, parodontite ulcéro-nécrotique, atteinte ulcérative ou ulcéro-nécrotique des muqueuses à la faveur d’un déséquilibre immunitaire local ou d’une agression virale primaire.
La gingivite hypertrophique juvénile, par exemple, peut être considérée comme une forme agressive de gingivite signant l’incapacité du système de défense local à maintenir un équilibre écologique. Elle peut soit être due à une dysfonction temporaire ou permanente du système immunitaire local ou à l’intervention de cofacteurs (infection virale – par exemple, calicivirale).
Rôle des bactéries
La bactériologie parodontale du chat a été étudiée15-17. S’il existe quelques variantes d’espèces bactériennes par rapport à l’homme ou le chien, les espèces et genres bactériens en cause sont néanmoins globalement similaires. Les chats atteints de stomatite présentent des titres plus élevés en immunoglobulines sériques contre certaines bactéries anaérobies telles que Porphyromonas sp. et Bacteroides sp. que les chats sains. Ces bactéries connues pour leur pouvoir parodontopathogène pourraient jouer un rôle13, 22.
Récemment, il a été suggéré que Bartonella sp. pourrait jouer un rôle étiologique parce que de nombreux chats à stomatite chronique présentent un test sérologique positif. Une étude récente utilisant des tests ELISA, Western-blot et PCR n’a pas pu montrer de corrélation entre les deux évènements20.
Les lésions de buccostomatite maxillaire et mandibulaire, principalement au niveau des carnassières, font penser à des lésions ulcératives en décalque (« kissing lesions ») liées à l’accumulation de plaque dentaire bactérienne chez des individus présentant une régulation immunitaire locale ou systémique qui est anormale. Le rôle joué par la flore parodontale semble confirmé par la bonne réponse au traitement par extraction dentaire.
Rôle des infections virales
Il ne semble pas exister de relation causale avec l’infection par les rétrovirus. Si les chats FIV positifs ont plus de risque de présenter une stomatite comme infection opportuniste lorsqu’ils sont immunodéprimés, il n’existe cependant pas de corrélation significative entre les chats atteints de stomatite et les chats FIV positifs.
Des études récentes ont montré que les calicivirus pouvaient être, à eux seuls, responsables de stomatite caudale (« faucitis ») aiguë. Dans les conditions expérimentales, une guérison spontanée et une absence d’excrétion de calicivirus sont notées au bout de quelques semaines21.
Le calicivirus est un petit virus à ARN de la famille des Caliciviridae. Ce virus existe avec de nombreux sérotypes (variants du virus présentant des antigènes de surfaces différents). Les calicivirus isolés sur le terrain se caractérisent par une très grande diversité antigénique. La région hypervariable E de la capside contient les principaux déterminants antigéniques. L’infection aiguë par le calicivirus provoque des lésions ulcératives focales ou multifocales de la langue et du palais.
Une étude rétrospective portant sur 6 866 chats et réalisée de 1980 à 1989 a montré que 20 % au total, et 44 % des chats présentant uniquement une gingivostomatite chronique féline, excrétaient des calicivirus alors qu’aucun des chats n’excrétait d’herpès virus. De plus, 70 % des chats présentant une gingivo-stomatite chronique féline en plus d’autres manifestations cliniques d’une infection calicivirale excrétaient des calicivirus3.
Dans une autre étude, presque tous les chats présentant une stomatite caudale ulcéro-proliférative excrétaient continuellement des calicivirus dans leurs sécrétions buccales18. Ce portage chronique a été confirmé par analyse PCR effectuée à partir d’écouvillonnages de la région buccale caudale. Dans cette étude, près de 100 % des chats présentant une stomatite caudale chronique étaient porteurs chroniques de calicivirus alors qu’uniquement 30 % des chats sans stomatite caudale étaient excréteurs10.
Néanmoins, il n’a pas été actuellement possible de reproduire expérimentalement une stomatite caudale chronique par infection calicivirale. Aucune corrélation n’a été mise en évidence entre l’aspect clinique, l’origine géographique et la chronologie de l’infection calicivirale. Il n’existe pas de biotypes spécifiques responsables respectivement des troubles respiratoires aigus, d’arthrite, de lésions ulcératives buccales ou de gingivo-stomatites chroniques11, 18, 19.
La même souche virale peut induire ces différentes manifestations cliniques. Il existe des différences antigéniques entre les souches isolées lors de gingivo-stomatite chronique ou d’infection respiratoire aiguë. Les souches isolées lors d’infections chroniques telles que la gingivo-stomatite, sont antigéniquement plus distantes que celles isolées lors d’infection virale aiguë19.
La chronicité de l’infection induit des modifications antigéniques favorisant l’émergence progressive de souches plus distantes sur le plan antigénique. Les variations antigéniques (résultant d’une série de mutations) sont induites par la pression de sélection immunitaire qui accompagne l’infection chronique et constituent ainsi un mode d’échappement immunitaire du virus19.
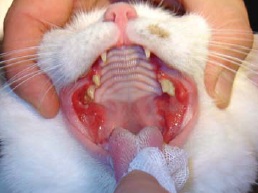
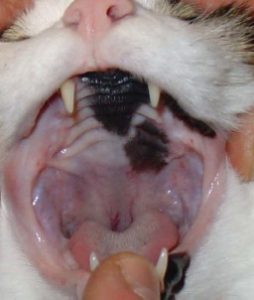
Rôle du système de défense
Aucune espèce bactérienne particulière ou aucun sérotype viral particulier ne différencie les chats malades des chats sains. Le complexe gingivo-stomatite chronique féline correspond sur le plan tissulaire au résultat du combat mené par le système de défense de l’hôte contre les agents agresseurs de la cavité buccale (bactéries et virus, en particulier calicivirus).
Le système de défense de l’hôte n’arrivant pas à gérer ces agressions locales, la stomatite chronique correspond en cela à une réaction dysimmunitaire. Aucune anomalie de la voie oxydative de l’activité bactéricide des neutrophiles ou du nombre de lymphocytes T helper (CD4+) n’a pu être mise en évidence chez le chat affecté1, 4.
La stomatite caudale chronique semble donc être un mode réactionnel particulier de la cavité buccale du chat qui est le résultat d’une réponse immunitaire locale inadaptée de certains individus à l’encontre d’antigènes bactériens ou viraux.
Approche thérapeutique
L’approche thérapeutique doit prendre en compte l’étiologie multifactorielle de cette entité clinique. Les lésions observées étant fonction de la réaction de l’hôte à l’encontre de différents agresseurs, seule la restauration d’une écologie buccale par élimination des différents facteurs et cofacteurs peut permettre une guérison.
Identification des cofacteurs
Prélèvements sanguins
- numération formule sanguine;
- tests FIV, FeLV;
- dosage des lymphocytes CD4+/CD8+ chez les chats FIV positifs.
- biochimie sanguine pour recherche d’une insuffisance organique ou métabolique (diabète sucré, insuffisance rénale chronique, hyperadrénocorticisme.)
Prélèvements buccaux
- recherche de portage chronique de calicivirus (PCR sur écouvillonnage buccal);
- la bactériologie buccale ne présente pas beaucoup d’intérêt puisqu’il s’agit d’une flore opportuniste;
- les biopsies et l’examen histologique peuvent être nécessaires pour exclure, en cas de doute, une tumeur buccale comme le carcinome épidermoïde.
Bilan bucco-dentaire
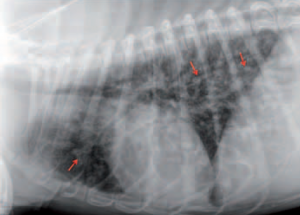
- radiographies dentaires de toutes les dents : détection des lésions de résorption dentaire, évaluation de la parodontite (résorption osseuse);
- bilan des lésions muqueuses (localisation, aspect, intensité).
Mise en œuvre des moyens techniques
La maîtrise de l’anesthésie et des moyens de réanimation per- et postopératoire est indispensable. La réanimation médicale (perfusion, alimentation) doit être adaptée au statut physiologique du chat. L’utilisation d’antalgiques (morphiniques, alpha2-agonistes, anti-inflammatoires non stéroïdiens) et d’anesthésiques locaux ou loco-régionaux prend une place importante dans le protocole d’anesthésie. En postopératoire, le contrôle de la douleur doit être continué et la réalimentation doit se faire au plus tôt.
La pose d’une sonde d’œsophagostomie permet une réalimentation rapide et efficace dans les cas les plus sévères.
Le praticien doit disposer des moyens techniques lui permettant de mener à bien, le plus rapidement possible l’acte de chirurgie buccale. L’équipement minimal nécessaire se compose de :
- un appareil de radiographie (appareil de radiographie dentaire de préférence) et des films dentaires taille 2;
- une unité dentaire électrique ou pneumatique avec spray d’irrigation permettant l’utilisation de contre-angle à grande vitesse ou de turbine à air;
- fraises fissures longues ISO 10 ou ISO 12;
- fraise ronde ISO 12 ou ISO 14;
- des élévateurs et/ou luxateurs de petite taille (2 mm);
- un davier pédiatrique pour incisives;
- un davier pour fragments radiculaires;
- un décolleur à périoste de petite taille (décolleur de Molt);
- une trousse de suture;
- du fil résorbable tressé ou monobrin 4-0, 5-0 ou 6-0 selon ses préférences.
Après avoir effectué un bilan radiographique dentaire complet, les dents atteintes de parodontite, les dents présentant des résorptions radiculaires et les dents entourées d’inflammation sévère des tissus mous (buccostomatite ulcérative ou ulcéro-proliférative) sont extraites.
Dans la plupart des cas, les extractions concernent toutes les prémolaires et molaires et éventuellement des incisives. Les canines peuvent être souvent conservées sauf si elles présentent elles-mêmes une atteinte sévère.
Les canines fracturées sont extraites ou subissent un traitement endodontique. Les extractions sont effectuées chirurgicalement, c’est-à-dire après avoir réalisé un lambeau muco-gingival et une ostectomie-ostéoplastie. En postopératoire, un traitement antibiotique de deux à trois semaines (Clindamycine, Doxycycline, Spiramycine-Métronidazole) est classiquement prescrit afin de réduire au maximum l’effet de la flore opportuniste.
L’inflammation et la douleur sont traitées ponctuellement avec des AINS (Meloxicam, par exemple) avec éventuellement l’adjonction de morphinique de longue durée d’action (Buprénorphine injectable ou sublinguale « transmuqueuse »).
Traitements et résultats
Gingivite hyperplasique juvénile
- traitement parodontal hygiénique (détartrage supra-gingival et débridement ultrasonique sous gingival, polissage à la cupule ou aéropolissage);
- gingivectomie (si hyperplasie sévère);
- hygiène bucco-dentaire (application quotidienne d’un gel de chlorhexidine);
- interféron recombinant félin (si PCR calicivirus positif);
- en cas de récidive et d’aggravation = extraction dentaire.
Stomatite caudale et buccostomatite
- traitement parodontal hygiénique (détartrage supra-gingival et débridement ultrasonique sous gingival, polissage à la cupule ou aéropolissage) : toutes les dents souffrant de parodontite faible à modérée sans autre lésion;
- extractions dentaires : dents présentant une lésion de résorption, dents souffrant de parodontite en présence de buccostomatite ou de stomatite caudale, dents à pulpe nécrotique en l’absence d’un traitement canalaire;
- en cas de récidive et d’aggravation = Interféron recombinant félin (si PCR calicivirus positif).
Une étude récente portant sur le traitement de 60 chats porteurs chroniques de calicivirus et présentant une stomatite caudale chronique est venue compléter une étude faite il y a 10 ans2, 7, 8. Les résultats de ces deux études montrent que l’approche thérapeutique proposée permet d’obtenir :
- la guérison clinique (arrêt de tout traitement) de 50-60 % des chats (figure 6);
- une amélioration significative (diminution nette du besoin en médicament) de 30-40 % des chats;
- une absence complète d’amélioration d’environ 10% des chats.
Le rôle de l’interféron recombinant félin (Virbagen®, Virbac, France) dans le traitement des « stomatites chroniques félines » est en cours d’investigation. Dans une étude pilote (Hennet, 2001 données non publiées), nous avons utilisé huit chats porteurs chroniques de calicivirus et présentant une stomatite caudale persistante après extraction dentaire.
Ces huit chats qui nécessitaient un traitement médical continu depuis l’intervention chirurgicale ont été mis sous traitement interféron (Virbagen®, Virbac, France) par voie systémique en l’absence de tout traitement médical. Il a été possible de maintenir ces chats pendant deux mois sans aucun autre traitement. Par contre, il n’a pas été observé d’amélioration des scores cliniques durant cette période. Une seconde étude vient récemment d’être effectuée (Hennet et al., 2006, données non publiées).
Vingt et un chats ont été inclus dans une étude en double aveugle sur quatre mois comparant le traitement à l’interféron par voie systémique (1MUI/Kg – 5 injections à 48 heures renouvelées 1 mois plus tard) à la corticothérapie orale.
Un cross-over a été effectué au bout de deux mois pour les chats ne présentant pas une réponse suffisante à l’issue du premier traitement (interféron ou corticoïde).
Les traitements additionnels (antibiotiques, AINS) nécessaires durant l’étude ont été recensés. Les résultats ont été évalués au travers de paramètres cliniques d’état général, de paramètres cliniques de lésions buccales et de paramètres comportementaux. Aucune différence statistiquement significative n’a été trouvée entre les deux traitements. Il semble donc possible grâce au traitement par l’interféron d’éviter une corticothérapie continue chez des chats présentant une stomatite caudale persistante après l’extraction des prémolaires et molaires. Plus récemment, l’intérêt se porte sur l’administration par voie orale transmuqueuse de Virbagen® à faible dose (100 000 UI par jour pendant deux à trois mois). Une étude devra venir confirmer les résultants encourageants des essais préliminaires (Southerdern).
La gingivo-stomatite chronique du chat est une entité clinique multifactorielle, parfois mal définie sur le plan lésionnel mais rebelle au traitement. Il semble plus adapté de discerner dans cette entité les chats présentant une stomatite caudale, le plus souvent ulcérative ou ulcéro-proliférative; les autres cas, étant à notre avis d’évolution beaucoup plus favorable. Si les mécanismes exacts conduisant à ces lésions ne sont pas encore bien élucidés, il semble néanmoins évident que le facteur individuel joue un rôle prépondérant.
L’incapacité de l’hôte à présenter une réaction de défense efficace ou suffisante face à des agressions bactériennes et virales semble être un facteur déterminant. De ce fait, les traitements visant à limiter la stimulation antigénique chronique et à rétablir l’écologie buccale donnent actuellement les meilleurs résultats.
Références
- Anderson JG, Pedersen NC. Characterization of T-lymphocyte subsets in cats with chronic lymphocytic plasmacytic gingivitis stomatitis complex. Proceeedings 10th Annual Veterinary Dental Forum 1996 : 113.
- Girard N, Hennet P. Retrospective study of dental extractions for the treatment of chronic caudal stomatitis in 60 calicivirus-positive cats. Proceedings 19th Annual Veterinary Dental Forum 2005 : 447.
- Harbour DA, Howard PE, Gaskell RM. Isolation of feline calicivirus and feline herpesvirus from domestic cats. 1980 to 1989. Vet Rec 1991; 128 : 77-80.
- Harvey CE, Campbell D. Neutrophil function in cats with chronic gingivitis-stomatitis. Proceeedings 3rd Annual Veterinary Dental Forum 1989 : 12-13.
- Harvey CE Oral inflammatory diseases in cats. J Am Anim Hosp Assn 1991; 27 : 585-591.
- Healey KA, Dawson S, Burrow R, Cripps P, Gaskell CJ, Hart CA, Pinchbeck GL, Radford AD, Gaskell RM. Prevalence of feline chronic gingivo-stomatitis in first opinion veterinary practice. J Feline Med Surg 2007; 9 : 373-81.
- Hennet P. Gingivo-stomatites chroniques félines : étude rétrospective. Prat Med Chir Anim Comp 1995; 30 : 453-460.
- Hennet P. Chronic gingivo-stomatitis in cats: longterm follow-up of 30 cases treated by dental extractions. Journal of Veterinary Dentistry 1997; 14 : 15-21.
- Hennet P. Les stomatites du chat. Prat Méd Chir Anim Comp 1999; 34 : 421-426.
- Hennet P, Boucraut-Baralon C. Relationship between oral calicivirus and herpesvirus carriage and palatoglossitis lesions. Proceedings 19th Annual Veterinary Dental Forum 2005 : 443.
- Horimoto T, Takeda Y, Iwatsuki-Horimoto K, Sugii S,Tajima T. Capsid protein gene variation among feline calicivirus isolates. Virus Genes 2001; 23 : 171-174.
- Johnessee JS, Hurvitz AI. Feline plasma cell gingivitis- stomatitis. J Amer Anim Hosp Assn 1983; 19 : 179-181.
- Kyriazidou A Brown PJ, Lucke VM. Immunohistochemical staining of neoplastic and inflammatory plasma cell lesions in feline tissues. J Comp Pathol 1989; 100 : 337-341.
- Lommer MJ, Verstraete FJM. Concurrent oral shedding of feline calicivirus and feline herpesvirus 1 in cats with chronic gingivostomatitis, Oral Microbiology and Immunology 2003; 18 : 131-134.
- Love DN, Vekselstein R, Collings S. The obligate and facultatively anaerobic bacterial flora of the normal feline gingival margin.Vet Microbiol 1990; 22 : 267-75.
- Mallonnee DH, Harvey CE, Venner M, Hammond BF. Bacteriology of periodontal disease in the cat. Arch Oral Biol 1988; 33 : 677-683.
- Norris JM, Love DN. Associations amongst three feline Porphyromonas species from the gingival margin of cats during periodontal health and disease. Vet Microbiol 1999; 65 : 195-207.
- Pedersen NC. Inflammatory oral cavity diseases of the cat. Vet Clin N Amer-Small Anim Pract 1992; 22 : 1323-1345.
- Poulet H, Brunet S, Soulier M, Leroy V, Goutebroze S, Chappuis G. Comparison between acute/respiratory and chronic stomatitis/gingivitis isolates of feline calicivirus: pathogenicity, antigenic profile and cross-neutralisation studies. Arch Virol 2000; 145 : 243-261.
- Quimby JM et al., Evaluation of the association of Bartonella species, feline herpesvirus 1, feline calicivirus, feline leukemia virus and feline immunodeficiency virus with chronic feline gingivostomatitis. J Feline Med Surg 2007 (in press).
- Reubel GH, Hoffmann DE, Pedersen NC. Acute and chronic faucitis of domestic cats. Vet Clin N Amer- Small Anim Pract 1992; 22 :1347-1360.
- Sims TJ, Moncla BJ, Page RC. Serum antibody response to antigens of oral gram-negative bacteria by cats with plasma-cell gingivitis-pharyngitis. J Dent Res 1990; 69 : 877-882.
- Southerdern P, Gorrel C. Treatment of a case of refractory feline chronic gingivo-stomatitis with feline recombinant interferon omega. Journal of Small Animal Practice 2007; 48 : 104–106.
- Verhaert L, Van Wetter C. Survey of oral diseases in cats in Flanders. Vlaams Diergeneeskundig Tijdschrift 2004; 73 : 331-341.
- White SD, Rosychuk RA, Janik TA, Denerolle P, Schultheiss P. Plasma cell stomatitis-pharyngitis in cats : 40 cases (1973-1991) J Amer Vet Med Assn 1992; 200 : 1377-1380.
(Formation à distance, article numéro 6)
Auteur

Philippe Hennet,
D.V., Dipl. AVDC, Dipl. EVDC, Dentisterie, Chirurgie maxillo-faciale et ORL,
Clinique Vétérinaire ADVETIA,
5, rue Dubrunfaut,
75012 Paris.
Paru dans le magazine : “Le Médecin Vétérinaire du Québec” Volume 36, No 3 • 2006-2007
Recherche
Investigation bactériologique sur les mortalités massives et saisonnières chez le pétoncle géant placopecten magellanicus
S. Cardin*
*Stéfanie Cardin, D.M.V., M.Sc. Mémoire présenté à la Faculté des études supérieures en vue de l’obtention du grade de Maître ès Sciences (M.Sc.) en sciences vétérinaires, option microbiologie, sous la direction du Dr Serge Messier.
Pour déterminer la cause bactérienne des mortalités massives et saisonnières du pétoncle géant Placopecten magellanicus enregistrées en Basse Côte-Nord, 50 pétoncles sains des Îles-de-la-Madeleine, 20 pétoncles sains et 20 pétoncles moribonds de la Basse Côte-Nord furent échantillonnés au niveau des branchies, de la glande digestive, du muscle et du broyat formé de ces trois organes.
Les bactéries récupérées ont été identifiées par des tests biochimiques, par séquençage d’ARNr 16S et par chromatographie en phase gazeuse. Suite à la comparaison des médianes avec le test de Cochran-Mantel- Haenszel des types bactériens retrouvés chez les pétoncles moribonds de la Basse Côte-Nord (Vibrio, Shewanella, Pseudoalteromonas/Pseudomonas/ Alteromonas, Psychrobacter, Colwellia, bactérie marine, Flavobacterium et Psychromonas) et ceux retrouvés chez les pétoncles sains de la Basse Côte-Nord (Vibrio, Pseudoalteromonas/pseudomonas/ Alteromonas, Psychrobacter, Shewanella, Flavobacterium, Colwellia et bactérie marine), aucune différence statistiquement significative n’a pu être établie (P>0,05).
L’état du système immunitaire des pétoncles fut aussi évalué chez 45 pétoncles de la Basse Côte-Nord et 45 pétoncles de la Nouvelle-Écosse avec les tests de phagocytose de microbilles de latex fluorescentes en microplaque.
Après la comparaison des pourcentages de phagocytose, nous avons pu établir que de façon générale la phagocytose était plus élevée chez les pétoncles de la Basse Côte-Nord (P<0,0001) et que le pourcentage de phagocytose était significativement moins élevé en septembre qu’en août et en octobre (P<0,0001), mais qu’il n’y avait pas de différence significative entre les mois d’août et d’octobre (P = 0,11).